题目内容
【题目】某铁的氧化物(FexO)1.52 g溶于足量盐酸中,向所得溶液中通入标准状况下112 mL Cl2,恰好将Fe2+完全氧化。下列说法正确的是( )
A. FexO溶于足量盐酸后只生成了FeCl3和H2O
B. 标准状况下112 mL Cl2的物质的量是5 mol
C. x=0.8
D. 通入Cl2后,发生反应的离子方程式:Fe2++Cl2![]() Fe3++2Cl﹣
Fe3++2Cl﹣
【答案】C
【解析】
A.某铁的氧化物(FexO)1.52g溶于足量盐酸中,再通入氯气,将Fe2+完全氧化生成Fe3+,所以FexO溶于HCl有FeCl2生成,故A错误;
B.标准状况下,氯气的物质的量是0.112L÷22.4L/mol=0.005mol,故B错误;
C.FexO中Fe的平均化合价为+2/x,被氧化为Fe3+,根据电子守恒可知,转移的电子数和Cl2转移的电子数相等。标准状况下112mLCl2转移电子数为0.005mol×2=0.01mol。则有:1.52g/(56x+16)g·mol-1×(3-2/x)×x=0.01mol,解得x=0.8,故C正确;
D.通入Cl2后,发生反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-,故D错误。
故答案选C。

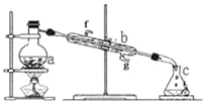
【题目】甲烷在加热条件下可还原氧化铜,气体产物除水蒸气外,还有碳的氧化物。某化学小组利用如图装置探究其反应产物。

[查阅资料]
①CO能与银氨溶液反应:CO+2[Ag(NH3)2]++2OH-===2Ag↓+2NH4++CO32-+2NH3
②Cu2O为红色,不与Ag+反应,能发生反应:Cu2O+2H+=Cu2++Cu+H2O
(1)装置A中反应的化学方程式为________________________________________。
(2)按气流方向各装置从左到右的连接顺序为A→____________。(填字母编号,装置不重复使用)
(3)实验中滴加稀盐酸的操作为____________________________________。
(4)已知气体产物中含有CO,则装置C中可观察到的现象是____________________;装置F的作用为_____________________。
(5)当反应结束后,装置D处试管中固体全部变为红色。
①设计实验证明红色固体中含有Cu2O:___________________________________________。
②为了证明红色固体中是否含有Cu,甲同学设计如下实验:向少量红色固体中加入适量0.1mol/L AgNO3溶液,发现溶液变蓝,据此判断红色固体中含有Cu。乙同学认为该方案不合理,欲证明甲同学的结论,还需增加如下对比实验,完成表中内容。
实验步骤(不要求写出具体操作过程) | 预期现象和结论 |
______________ | 若观察到溶液不变蓝,则证明红色固体中含有Cu;若观察到溶液变蓝,则不能证明红色固体中含有Cu |