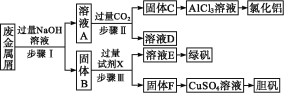
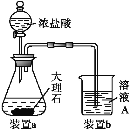
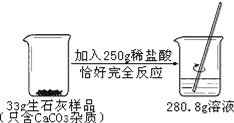
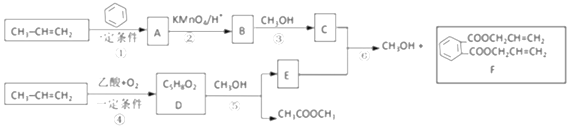
题目内容
【题目】已知:①C2H6(g)![]() C2H4(g)+H2(g) H1 >0。
C2H4(g)+H2(g) H1 >0。
②C2H6(g)+![]() =2CO2(g)+3H2O(l) H 2 =-1559.8 kJ·mol-1
=2CO2(g)+3H2O(l) H 2 =-1559.8 kJ·mol-1
③C2H4(g)+3O2(g)=2CO2(g)+2H2O(l) H 3=-1411.0 kJ·mol-1
下列叙述正确的是
A.升温或加压均能提高①中乙烷的转化率
B.①中断键吸收的能量少于成键放出的能量
C.用H 2和H 3可计算出①中的H
D.推测1 mol C2H2(g)完全燃烧放出的热量小于1411.0 kJ
【答案】D
【解析】
A.①为反应前后气体分子数增加的反应,故加压使反应向逆向移动,乙烷的转化率降低,A错误;
B.①为吸热反应,反应中断键吸收的能量大于成键放出的能量,B错误;
C.反应②③中不存在反应①中生成的氢气,故不能通过盖斯定律用H 2和H 3可计算出①中的H,C错误;
D.根据②③推断,C2Hn中n值越小,释放的能量越小,推测1 mol C2H2(g)完全燃烧放出的热量小于1411.0 kJ,D正确;
答案选D。

练习册系列答案
相关题目