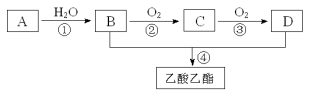
题目内容
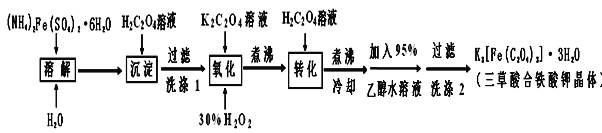
【题目】某工厂废金属屑的主要成分为Cu、Fe和Al,此外还含有少量Al2O3和Fe2O3,为探索工业废料的再利用,某化学兴趣小组设计了如下实验流程,用该工厂的金属废料制取氯化铝、绿矾晶体(FeSO4·7H2O)和胆矾晶体。
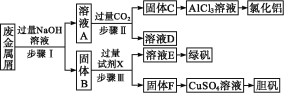
完成下列填空:
(1)写出步骤Ⅰ反应的离子方程式:___。
(2)试剂X是___,溶液D是___。
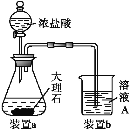
(3)在步骤Ⅱ中,用如图装置制取CO2并通入溶液A中。一段时间后,仍观察不到烧杯中产生白色沉淀。为了固体C的生成,在药品和装置上可采取的改进措施是___。
(4)溶液E中加入KSCN溶液无明显现象,表明滤液中不存在Fe3+,用离子方程式解释其可能的原因:___。
(5)将固体F继续加入热的稀硫酸,同时不断鼓入空气,固体溶解得CuSO4溶液,写出反应的化学方程式:___。
【答案】![]() 、
、![]() 稀硫酸 NaHCO3溶液 浓盐酸改为稀盐酸;在装置a和装置b之间增加一个盛有饱和NaHCO3溶液的洗气瓶,以除去装置a中挥发出的HCl 2Fe3++Fe=3Fe2+、2Fe3++Cu=2Fe2++Cu2+
稀硫酸 NaHCO3溶液 浓盐酸改为稀盐酸;在装置a和装置b之间增加一个盛有饱和NaHCO3溶液的洗气瓶,以除去装置a中挥发出的HCl 2Fe3++Fe=3Fe2+、2Fe3++Cu=2Fe2++Cu2+ ![]()
【解析】
Fe、Cu、Fe2O3都不与NaOH溶液反应,Al和Al2O3可与NaOH溶液反应,用含有Al、Fe、Cu和Al2O3和Fe2O3的废金属屑制取AlCl3、绿矾晶体(FeSO47H2O)和胆矾晶体流程为:合金中Al、Al2O3与NaOH反应,所得滤液A为NaAlO2溶液,经途径Ⅱ与足量二氧化碳发生反应:![]() ,反应可生成Al(OH)3固体C,生成的Al(OH)3再和盐酸反应生成AlCl3,得到的AlCl3较纯净;溶液D为NaHCO3溶液;滤渣B为Fe和Cu的化合物,加入足量稀硫酸,得到的滤液E为FeSO4,经蒸发浓缩、冷却结晶可得到绿矾,滤渣F为Cu,可用于制备胆矾,据此分析解答。
,反应可生成Al(OH)3固体C,生成的Al(OH)3再和盐酸反应生成AlCl3,得到的AlCl3较纯净;溶液D为NaHCO3溶液;滤渣B为Fe和Cu的化合物,加入足量稀硫酸,得到的滤液E为FeSO4,经蒸发浓缩、冷却结晶可得到绿矾,滤渣F为Cu,可用于制备胆矾,据此分析解答。
(1)铝、氧化铝与氢氧化钠反应,所得滤液A为NaAlO2溶液,反应的离子方程式为:![]() 、
、![]() ;
;
(2)金属铁和金属铜不与氢氧化钠溶液反应,金属铜和稀硫酸之间不反应,但是金属铁可以和稀硫酸之间反应生成硫酸亚铁和氢气,进而制得绿矾晶体,所以试剂X为稀硫酸;溶液D为NaHCO3溶液;
(3)进行步骤Ⅱ时,该小组用如图所示装置及试剂将制得的CO2气体通入溶液A中,一段时间后,观察到烧杯中产生的白色沉淀逐渐减少,其原因是二氧化碳气体中含有从盐酸中挥发出的HCl气体,氯化氢在水中溶解了部分沉淀,发生的反应为:Al(OH)3+3H+=Al3++3H2O,为了避免固体C减少,可在制取二氧化碳的收集装置中增加一个洗去HCl的装置,二氧化碳在饱和NaHCO3中不溶,氯化氢和NaHCO3反应生成二氧化碳气体,所以可降低盐酸浓度;在装置I和Ⅱ之间增加一个盛有饱和NaHCO3溶液的洗气瓶,除去二氧化碳中的氯化氢;
(4)溶液E中加入KSCN溶液无明显现象,表明滤液中不存在Fe3+,原因是Fe3+被Fe、Cu还原生成Fe2+,所以加入KSCN溶液没有明显现象,故答案为:2Fe3++Fe=3Fe2+、2Fe3++Cu=2Fe2++Cu2+;
(5)用固体F继续加入热的稀H2SO4,同时不断鼓入空气,固体溶解得CuSO4溶液,说明在加热条件下,Cu、氧气和稀硫酸发生氧化还原反应生成硫酸铜和水,反应的化学方程式为:![]() 。
。