题目内容
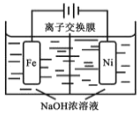
【题目】环己酮(![]() )在生产生活中有重要的用途,可在酸性溶液中用环己醇间接电解氧化法制备,其原理如图所示。下列说法正确的是
)在生产生活中有重要的用途,可在酸性溶液中用环己醇间接电解氧化法制备,其原理如图所示。下列说法正确的是
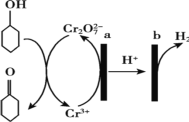
A.a 极与电源负极相连
B.a 极电极反应式是 2Cr3+- 6e- +14OH-= Cr2O72-+7H2O
C.b 极发生氧化反应
D.理论上生成 1mol 环己酮时,有 1molH2 生成
【答案】D
【解析】
根据原理图可知,a极为电解池的阳极,Cr3+失电子发生氧化反应,电极反应式是2Cr3+- 6e- +7H2O= Cr2O72-+14H+,b极为阴极,氢离子得电子发生还原反应生成氢气,结合转移电子数相等计算,据此分析解答。
A. 根据原理图可知,a极为电解池的阳极,则与电源正极相连,故A错误;
B. 根据原理图可知,a极为电解池的阳极,Cr3+失电子发生氧化反应,电极反应式是2Cr3+- 6e- +7H2O= Cr2O72-+14H+,故B错误;
C. b极为阴极,氢离子得电子发生还原反应,故C错误;
D. 理论上由环己醇(C6H12O)生成1mol环己酮(C6H10O),转移2mol电子,根据电子守恒可知,阴极有1mol氢气放出,故D正确;
故选D。

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目