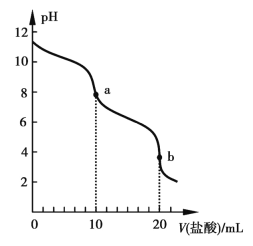
��Ŀ����
����Ŀ����25��ʱ���̶��ݻ����ܱ�������X��Y��Z��������ij�ʼŨ�Ⱥ�ƽ��Ũ�����±�������ƽ����Ҫ��ʱ��Ϊ20 s��������˵������ȷ���ǣ�������
���� | X | Y | Z |
��ʼŨ�ȣ���mol��L��1�� | 0.2 | 0.1 | 0.1 |
ƽ��Ũ�ȣ���mol��L��1�� | 0.05 | 0.05 | 0.2 |
A. ��Ӧ�ɱ�ʾΪ3X+Y ![]() 2Z
2Z
B. ����ƽ������У���Z��ʾ�ķ�Ӧ����Ϊv(Z)=0.005 mol��L��1��s��1
C. ��ƽ���X��YŨ�ȷֱ�����0.35 mol��L��1��0.15 mol��L��1��ƽ�����ƣ�X��ת���ʱ�С
D. ����ʼŨ�ȣ�XΪ0.2 mol��L��1��YΪ0.2 mol��L��1��ZΪ0.8mol��L��1����v��>v��
���𰸡�C
��������
A��ƽ��Ũ�����ʼŨ�Ȳ�ֵ�ı�ֵΪ3��1��2��X��Y���٣�Z���ӣ���Ӧ�ɱ�ʾΪ��
3X+Y ![]() 2Z��A����ȷ��
2Z��A����ȷ��
B����Z��ƽ��Ũ�ȼ�ȥ��ʼŨ���ٳ��Է�Ӧʱ��ɵ÷�v(Z)=0.005 mol��L��1��s��1��B����ȷ��
C��X��YŨ�ȷֱ�����0.35 mol��L��1��0.15 mol��L��1�� X��Y�ı�ֵ��2��1��Ϊ11��5�������֮ǰ���ӽ���Ӧʽ�ı�ֵ��X��ת�������ӣ�C�����
D������ʼŨ�ȣ�XΪ0.2 mol��L��1��YΪ0.2 mol��L��1��ZΪ0.8mol��L��1ʱ����ʱŨ����С��ƽ�ⳣ������÷�Ӧ������У���v��>v����D����ȷ��
���Դ�ѡ��C�