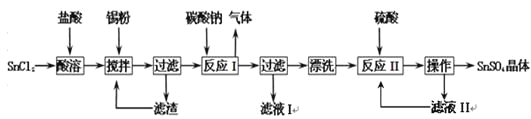
题目内容
【题目】将0.15mol的MnO2与过量的12mol/L的浓盐酸反应,与50ml 12mol/L的浓盐酸与过量MnO2反应,两者产生的氯气相比(其它反应条件相同)
A.一样多 B.前者较后者多 C.后者较前者多 D.无法比较
【答案】B
【解析】
试题分析:0.15mol MnO2与过量的12molL-1的浓盐酸反应,浓盐酸过量,二氧化锰完全反应
MnO2 +4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
1 1
0.15mol 0.15mol
所以产生氯气的物质的量是0.15mol,50mL 12molL-1的浓盐酸与足量MnO2反应,盐酸的物质的量为:12molL-1×0.05L=0.6mol,二氧化锰过量,若盐酸完全反应根据方程式计算
MnO2 +4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
4 1
0.6mol 0.15mol
所以理论上产生氯气的物质的量是0.15mol,但是,50mL 12molL-1的浓盐酸与足量MnO2反应过程中盐酸的浓度不断减小,而稀盐酸与二氧化锰不发生反应,所以说最终产生的氯气小于0.15mol,故A、C、D错误;故选B。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目