题目内容
【题目】298 K时,向20 mL 0.1 mol·L1ROH溶液中滴加0.1 mol·L1盐酸,混合溶液的pH与盐酸体积的关系如图所示。已知298 K时ROH的电离度为1.37%,lg 1.37≈0.1。下列说法正确的是
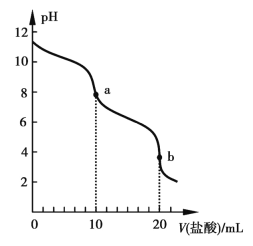
A. 水的电离程度:a>b
B. pH=7时,溶液中c(R+)=c(Cl)=c(H+)=c(OH)
C. b点溶液中存在c(C![]() )>c(R+)>c(OH)>c(H+)
)>c(R+)>c(OH)>c(H+)
D. 298 K时0.1 mol·L1ROH溶液的pH≈11.1
【答案】D
【解析】
A.a点对应的溶液中c(ROH)=c(RCl),ROH电离而使溶液呈碱性,水的电离受到抑制,b点对应的溶液溶质是RCl,RCl水解使溶液呈弱酸性,水的电离受到促进,故b点溶液中水的电离程度较大,A项错误;B.中性溶液中溶质是ROH和RCl,c(R+)=c(Cl-)>c(H+)=c(OH-),B项错误;C.b点溶液呈酸性,溶液中c(H+)>c(OH-),C项错误;D.c(OH-)=0.1 mol·L-1×1.37%=1.37×10-3mol·L-1;pH=-lgc(H+)=14-pOH=14-(3-lg 1.37)≈11.1,D项正确。答案:D。

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案【题目】下表中评价合理的是
选项 | 化学反应及其离子方程式 | 评 价 |
A | NaHSO4溶液与Ba(OH)2溶液反应至 SO42-沉淀完全: 2H++SO42-+Ba2++2OH- = BaSO4↓ + 2H2O | 正 确 |
B | 向碳酸镁溶液中加入足量稀盐酸: CO32-+2H+=CO2↑+H2O | 错误,碳酸镁不应写成离子形式 |
C | 向沸水中滴加饱和的氯化铁溶液至液体变为红褐色: Fe3++3H2O = Fe(OH)3↓+3H+ | 正 确 |
D | NaOH溶液中通入少量CO2反应:OH-+CO2=HCO3- | 正 确 |
【题目】在25℃时,固定容积的密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表,建立平衡需要的时间为20 s,则下列说法不正确的是( )
物质 | X | Y | Z |
初始浓度/(mol·L-1) | 0.2 | 0.1 | 0.1 |
平衡浓度/(mol·L-1) | 0.05 | 0.05 | 0.2 |
A. 反应可表示为3X+Y ![]() 2Z
2Z
B. 建立平衡过程中,用Z表示的反应速率为v(Z)=0.005 mol·L-1·s-1
C. 达平衡后,X、Y浓度分别增加0.35 mol·L-1和0.15 mol·L-1,平衡正移,X的转化率变小
D. 若初始浓度:X为0.2 mol·L-1,Y为0.2 mol·L-1,Z为0.8mol·L-1,则v正>v逆