题目内容
【题目】反应4HCl(g)+O2(g) ![]() 2Cl2(g)+2H2O(g)中,4 mol HCl 被氧化,放出115.6 kJ的热量。
2Cl2(g)+2H2O(g)中,4 mol HCl 被氧化,放出115.6 kJ的热量。
又知:![]()

![]() ,
,![]()

 ;
;
判断下列说法正确的是( )
A. 该反应的ΔH=+115.6 kJ·mol-1
B. 断开1 mol H—O 键与断开1 mol H—Cl 键所需能量相差约为32 kJ
C. HCl中H—Cl 键比H2O中H—O键稳定
D. 由题中所提供信息判断氯元素的非金属性比氧元素强
【答案】B
【解析】
A.该反应为放热反应的焓变小于0,A项错误;
B.由反应放出的热量与所给的键能数据,可得ΔH=4×H—Cl键的键能+1×O—O的键能-2×Cl—Cl键的键能-4×H—O 键的键能,通过计算可得H-O键的键能减去H-Cl键的键能为31.9kJ,B项正确;
C.由B项可得氢氧键比氢氯键稳定,C项错误;
D.非金属性的强弱与键能无关,D项错误;
所以答案选择B项。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】在25℃时,固定容积的密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表,建立平衡需要的时间为20 s,则下列说法不正确的是( )
物质 | X | Y | Z |
初始浓度/(mol·L-1) | 0.2 | 0.1 | 0.1 |
平衡浓度/(mol·L-1) | 0.05 | 0.05 | 0.2 |
A. 反应可表示为3X+Y ![]() 2Z
2Z
B. 建立平衡过程中,用Z表示的反应速率为v(Z)=0.005 mol·L-1·s-1
C. 达平衡后,X、Y浓度分别增加0.35 mol·L-1和0.15 mol·L-1,平衡正移,X的转化率变小
D. 若初始浓度:X为0.2 mol·L-1,Y为0.2 mol·L-1,Z为0.8mol·L-1,则v正>v逆
【题目】现有四组分散系:①汽油和水形成的乳浊液 ②含有泥沙的食盐水 ③溶有碘(I2)的碘化钾溶液 ④乙二醇和丙三醇混合溶液(乙二醇和丙三醇的部分物理性质见下表)。
物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 | 溶解性 |
乙二醇 | -11.5 | 198 | 1.11 | 易溶于水和乙醇 |
丙三醇 | 17.9 | 290 | 1.26 | 能跟水、酒精以任意比互溶 |
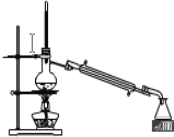
请用下图所示的仪器分离以上各混合液,仪器和方法不能对应的是 ( )
(1)![]() (2)
(2)![]() (3)
(3)![]() (4)
(4)![]()
A.①-(3)-分液B.②-(2)-过滤
C.③-(2)-萃取D.④-(1)-蒸馏