题目内容
【题目】(1)将不同量的CO(g)和H2O(g)分别通入体积为2 L的恒容密闭容器中,进行反应CO(g)+H2O(g)![]() CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O | CO | H2 | CO | |||
1 | 650 | 2 | 4 | 1.6 | 2.4 | 6 |
2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
3 | 900 | a | b | c | d | t |
①实验1中从反应开始至平衡以CO2表示的平均反应速率为v(CO2)=____(取小数点后两位,下同)。
②该反应的正反应为___(填“吸”或“放”)热反应,实验2条件下平衡常数K=___。
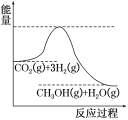
(2)目前工业上有一种方法是用CO2来生产甲醇。一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,达到平衡后下列措施中能使c(CH3OH)增大的是____。
CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,达到平衡后下列措施中能使c(CH3OH)增大的是____。
a.升高温度 b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来 d.再充入1 mol CO2和3 mol H2
【答案】0.13mol·L-1·min-1 放 0.17 cd
【解析】
(1)①根据v(CO2)=![]() 计算二氧化碳平均反应速率;②根据实验1、2转化率与温度的关系分析判断其反应热;根据化学平衡常数K=
计算二氧化碳平均反应速率;②根据实验1、2转化率与温度的关系分析判断其反应热;根据化学平衡常数K=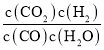 计算;
计算;
(2)根据反应过程中能量变化图像知,该反应是放热反应,能使c(CH3OH)增大,说明平衡向正反应方向移动,据此分析判断。
(1)①根据表格数据,反应的CO为1.6mol,则生成的CO2为1.6mol,v(CO2)=![]() =
= =0.13mol/(L·min),故答案为:0.13mol/(L·min);
=0.13mol/(L·min),故答案为:0.13mol/(L·min);
②实验1中CO的转化率为:![]() ×100%=40%,实验2中CO的转化率为:
×100%=40%,实验2中CO的转化率为:![]() ×100%=20%,温度升高,反应物的转化率降低,平衡逆向移动,则逆向为吸热反应,所以正向为放热反应;实验2条件下,平衡时c(CO)=
×100%=20%,温度升高,反应物的转化率降低,平衡逆向移动,则逆向为吸热反应,所以正向为放热反应;实验2条件下,平衡时c(CO)=![]() =0.8mol/L,c(H2)=
=0.8mol/L,c(H2)=![]() =0.2mol/L,c(H2O)=
=0.2mol/L,c(H2O)=![]() =0.6mol/L,c(CO2)=c(H2)=
=0.6mol/L,c(CO2)=c(H2)=![]() =0.2mol/L,化学平衡常数K=
=0.2mol/L,化学平衡常数K=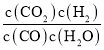 =
=![]() =0.17,故答案为:放;0.17;
=0.17,故答案为:放;0.17;
(2)根据反应过程中能量变化图像可知反应物的总能量大于生成物的总能量,则该反应为放热反应。a.升高温度,平衡逆向移动,c(CH3OH)减小,故a错误;b.充入He(g),使体系压强增大,由于容器为恒容容器,各组分浓度不变,平衡不移动,c(CH3OH)不变,故b错误;c.将H2O(g)从体系中分离出来,平衡正向移动,c(CH3OH)增大,故c正确;d.再充入1mol CO2和3molH2,平衡正向移动,c(CH3OH)增大,故d正确;故答案为:cd。

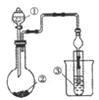
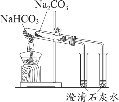
【题目】利用图示装置进行实验,不能得出相应结论的是( )
溶液① | 固体② | 溶液③ | 实验结论 |
| |
A | 稀硫酸 | Na2CO3 | Na2SiO3 | 非金属性:S>C>Si | |
B | 浓盐酸 | KMnO4 | Na2S | 氧化性:KMnO4>Cl2>S | |
C | 浓H2SO4 | Cu | 氢硫酸 | 溶液变浑浊 | |
D | 浓氨水 | CaO | AlCl3 | 可以制备Al(OH)3 |
A. A B. B C. C D. D