题目内容
20.X、Y、Z、Q、R是原子序数依次增大的短周期主族元素.已知:气体YX3能使润湿的红色石蕊试纸变蓝,Z和X在同一主族,Q原子的最外层电子数是其周期序数的2倍.回答下列问题:(1)Z原子的结构示意图为
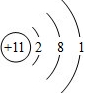 ,YX3的电子式为
,YX3的电子式为 (用元素符号表示).
(用元素符号表示).(2)Z、Q、R原子的半径从大到小的顺序是Na>S>Cl(用元素符号表示).
(3)Q分别与X、Z形成的化合物类型分别为共价化合物、离子化合物(填离子化合物或共价化合物).
(4)能证明R的非金属性比Q强的实验事实是bc(填字母序号).
a.HR的水溶液酸性比H2Q的水溶液酸性强
b.R2与H2化合比Q与H2化合容易,且HR的稳定性比H2Q强
c.H2Q的水溶液中通少量的R2气体可置换出单质Q.
分析 X、Y、Z、Q、R是原子序数依次增大的短周期主族元素,气体YX3能使润湿的红色石蕊试纸变蓝,该气体为氨气,则Y为N,X为H,Z和X在同一主族,则Z为Na,Q原子的最外层电子数是其周期序数的2倍,即最外层有6个电子,所以Q为S,则R为Cl,据此答题.
解答 解:X、Y、Z、Q、R是原子序数依次增大的短周期主族元素,气体YX3能使润湿的红色石蕊试纸变蓝,该气体为氨气,则Y为N,X为H,Z和X在同一主族,则Z为Na,Q原子的最外层电子数是其周期序数的2倍,即最外层有6个电子,所以Q为S,则R为Cl,
(1)Z为Na,Z原子的结构示意图为  ,NH3的电子式为
,NH3的电子式为 ,
,
故答案为: ;
; ;
;
(2)电子层数相同,核电荷数越多,原子半径越小,所以Na、S、Cl原子的半径从大到小的顺序是Na>S>Cl,
故答案为:Na>S>Cl;
(3)Q分别与X、Z形成的化合物分别为H2S、Na2S,H2S是共价化合物,Na2S是离子化合物,
故答案为:共价化合物、离子化合物;
(4)a.元素的最高价氧化物的水化物的酸性越强,元素的非金属性越强,HCl的水溶液酸性比H2S的水溶液酸性强,不能说明氯的非金属性比硫强,故a错误;
b.元素的非金属性越强,气态氢化物越稳定,所以Cl2与H2化合比S与H2化合容易,且HCl的稳定性比H2S强,能证明氯的非金属性比硫强,故b正确;
c.H2S的水溶液中通少量的Cl2气体可置换出单质S,说明Cl2的氧化性强于S,所以能证明氯的非金属性比硫强,故c正确;
故选bc.
点评 本题以元素推断为载体考查了原子结构、电子式、元素周期律等知识,难度不大,解题 的关键是元素的确定,注意根据物质特有的性质和原子结构特点进行元素推断.

练习册系列答案
相关题目
10.下列有关物质分类的说法中,正确的是( )
| A. | SiO2不能和水反应,所以它不是酸性氧化物 | |
| B. | 只由一种元素组成的物质必然是纯净物 | |
| C. | 烧碱、冰醋酸、石墨均为电解质 | |
| D. | 海水、氯水、氨水均为混合物 |
11.如图表示中和滴定前某同学的一个操作,下列叙述正确的是( )
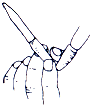

| A. | 这是一个错误操作 | |
| B. | 该操作是为了排除滴定管内气泡 | |
| C. | 该滴定管为酸式滴定管 | |
| D. | 该操作是为了调节滴定管内液体的液面高低 |
8.下列化学用语正确的是( )
| A. | HCl的电子式: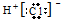 | B. | 氯离子的结构示意图: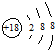 | ||
| C. | 甲烷分子的比例模型: | D. | 核内有8个中子的碳原子:${\;}_{6}^{8}$C |
15.下列有关物质用途的说法不正确的是( )
| A. | 碳酸氢铵常用作氮肥 | B. | 浓硫酸可用于干燥氨气 | ||
| C. | 油脂可以制造肥皂 | D. | 食醋可用于清除暖水瓶中的水垢 |
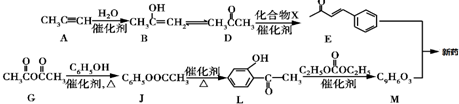
5.碳原子数为12且只有两个侧链的苯的同系物的同分异构体数目为( )
| A. | 42 | B. | 45 | C. | 48 | D. | 60 |
 .
.