题目内容
9.写出下列中和反应的离子方程式:(1)硫酸和氢氧化钠溶液;
(2)硫酸和氢氧化钡溶液;
(3)氢氧化铁和盐酸;
(4)氨水和盐酸.
分析 (1)硫酸和氢氧化钠溶液反应生成硫酸钠和水,反应实质为氢离子与氢氧根离子反应生成水;
(2)硫酸和氢氧化钡溶液反应生成硫酸钡沉淀和水;
(3)氢氧化铁和盐酸反应生成氯化铁和水,离子方程式中氢氧化铁不能拆开;
(4)氨水和盐酸反应生成氯化铵和水,一水合氨不能拆开,需要保留分子式.
解答 解:(1)硫酸中和氢氧化钠反应实质是氢离子和氢氧根离子反应,其反应的离子方程式为:OH-+H+=H2O,故答案为:OH-+H+=H2O;
(2)氢氧化钡与稀硫酸反应生成硫酸钡和水,反应的离子方程为:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,故答案为:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O;
(3)氢氧化铁和盐酸反应生成氯化铁和水,反应的离子方程式为:Fe(OH)3+3H+=Fe3++3H2O,故答案为:Fe(OH)3+3H+=Fe3++3H2O;
(4)氨水和盐酸反应生成氯化铵和水,反应的离子方程式为:NH3•H2O+H+=H2O+NH4+,故答案网为:NH3•H2O+H+=H2O+NH4+.
点评 本题考查了离子方程式的书写,题目难度中等,注意掌握离子方程式的概念、表示意义及书写原则,把握需要保留化学式的物质,如难溶物、弱电解质、氧化物,还要明确离子方程式满足守恒关系如:质量守恒定律、电荷守恒、电子守恒.

练习册系列答案
相关题目
19.下列说法正确的是( )
| A. | 溶液是电中性的,胶体则是带电的 | |
| B. | 次氯酸具有强氧化性,属于强电解质 | |
| C. | 铜在氯气中燃烧产生棕色的烟,产物的稀溶液为蓝色 | |
| D. | 铁与稀硝酸充分反应后铁没有剩余,则溶液中一定有Fe3+ |
4.Na2SO3和浓H2SO4作用产生气体X,碳酸氢铵热分解生成的气体依次通过硅胶、Na2O2、浓H2SO4,最后得到气体Y,将X,Y分别通入氢硫酸中产生的现象是( )
| A. | 通入X溶液浑浊,通入Y无明显现象 | B. | 通入X现象不明显,通入Y溶液浑浊 | ||
| C. | 通入X和Y溶液均无明显现象 | D. | 通入X和Y溶液均浑浊 |
1.阿伏伽德罗常数是物理学和化学中的一个重要常量.下列说法正确的是(NA为阿伏伽德罗常数)( )
| A. | 28g氮气含有的原子数为NA | |
| B. | 4g金属钙的物质的量为1mol | |
| C. | 1mol O2分子的质量等于1mol氧原子的质量 | |
| D. | 24g O2分子和24g O3分子所含的氧原子数相等 |
8.室温时,将浓度和体积分别为c1、V1的NaOH溶液和c2、V2的CH3COOH溶液相混合,下列关于该混合溶液的叙述错误的是( )
| A. | 若pH>7,则一定是c1V1≥c2V2 | |
| B. | 在任何情况下都是c(Na+)+c(H+)═c(CH3COO-)+c(OH-) | |
| C. | 当醋酸和氢氧化钠溶液恰好完全反应后,滴加酚酞溶液,颜色变红 | |
| D. | 反应的离子方程式为:H++OH-═H20 |
9.二氧化硫是硫的重要化合物,在生产、生活中有广泛应用.二氧化硫有毒,并且是形成酸雨的主要气体.无论是实验室制备还是工业生产,二氧化硫尾气吸收或烟气脱硫都非常重要.完成下列填空:
(1)实验室可用铜和浓硫酸加热或硫酸和亚硫酸钠反应制取二氧化硫.
写出反应的化学方程式Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
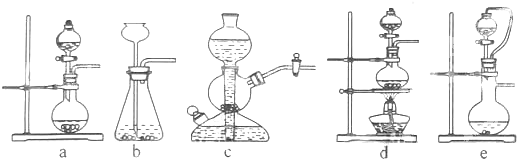
如果硫酸和亚硫酸钠反应制取二氧化硫,并希望能控制反应速度,图中可选用的发生装置是ae (填写字母).
(2)若用硫酸和亚硫酸钠反应制取3.36L(标准状况)二氧化硫,至少需要称取亚硫酸钠18.9g(保留一位小数);如果已有4.0%亚硫酸钠(质量分数)被氧化成硫酸钠,则至少需称取该亚硫酸钠19.8 g (保留一位小数).
(3)实验室二氧化硫尾气吸收与工业烟气脱硫的化学原理相通.石灰-石膏法和碱法是常用的烟气脱硫法.石灰-石膏法的吸收反应为SO2+Ca(OH)2→CaSO3↓+H2O.吸收产物亚硫酸钙由管道输送至氧化塔氧化,反应为2CaSO3+O2+4H2O→2CaSO4•2H2O.其流程如图: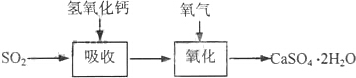
碱法的吸收反应为SO2+2NaOH→Na2SO3+H2O.碱法的特点是氢氧化钠碱性强、吸收快、效率高.其流程如图: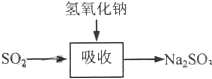
石灰-石膏法和碱法吸收二氧化硫的化学原理相同之处是利用SO2是酸性氧化物,可与碱反应.和碱法相比,石灰-石膏法的优点是原料易得,吸收成本低,缺点是亚硫酸钙在输送中容易造成管道堵塞,吸收速率慢,效率低.
(1)实验室可用铜和浓硫酸加热或硫酸和亚硫酸钠反应制取二氧化硫.
写出反应的化学方程式Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.

如果硫酸和亚硫酸钠反应制取二氧化硫,并希望能控制反应速度,图中可选用的发生装置是ae (填写字母).
(2)若用硫酸和亚硫酸钠反应制取3.36L(标准状况)二氧化硫,至少需要称取亚硫酸钠18.9g(保留一位小数);如果已有4.0%亚硫酸钠(质量分数)被氧化成硫酸钠,则至少需称取该亚硫酸钠19.8 g (保留一位小数).
(3)实验室二氧化硫尾气吸收与工业烟气脱硫的化学原理相通.石灰-石膏法和碱法是常用的烟气脱硫法.石灰-石膏法的吸收反应为SO2+Ca(OH)2→CaSO3↓+H2O.吸收产物亚硫酸钙由管道输送至氧化塔氧化,反应为2CaSO3+O2+4H2O→2CaSO4•2H2O.其流程如图:

碱法的吸收反应为SO2+2NaOH→Na2SO3+H2O.碱法的特点是氢氧化钠碱性强、吸收快、效率高.其流程如图:

| 试剂 | Ca(OH)2 | NaOH |
| 价格(元/kg) | 0.36 | 2.9 |
| 吸收SO2的成本(元/mol) | 0.027 | 0.232 |
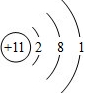 ,YX3的电子式为
,YX3的电子式为 (用元素符号表示).
(用元素符号表示). 下表为某市售盐酸试剂瓶标签上的部分信息:
下表为某市售盐酸试剂瓶标签上的部分信息: