题目内容
12. BaS是一种白色晶体,微溶于水,可用于制备立德粉、Na2S等.工业上可用H2与重晶石(BaS04)在高温下反应制备BaS,热化学方程式为BaS04(s)+4H2(g)?BaS(s)+4H20(g)△H=+xkJ•mol-1(x>0).回答下列问题:
BaS是一种白色晶体,微溶于水,可用于制备立德粉、Na2S等.工业上可用H2与重晶石(BaS04)在高温下反应制备BaS,热化学方程式为BaS04(s)+4H2(g)?BaS(s)+4H20(g)△H=+xkJ•mol-1(x>0).回答下列问题:(1)在温度和容积不变的条件下,能说明该反应己达到平衡状态的是cd(填字母序号).
a.n(H2)=n(H2O)
b.容器内压强保持不变
c.v正(H2)=v逆(H2O)
d.水蒸气的浓度保持不变
(2)平衡后下列措施既可提高反应速率,又可提高H2的转化率的是b(填字母序号).
a.使用催化剂
b.升高反应体系的温度
c.增大反应容器的体积
d.及时从反应体系中分离出水蒸气
(3)将温度恒定为T℃,向体积为2L的密闭容器中加入一定量的重晶石和H2.在不同时间测得H2的物质的量如下表:
| 时间/min | 0 | t | 2t | 3t | 4t |
| n(H2)/mol | 2.00 | 1.50 | n | 0.90 | 0.80 |
②若氢气的平衡转化率为a,则该温度下反应的化学平衡常数K=$\frac{{a}^{4}}{(1-a)^{4}}$(用含a的代数式表示);若测得该反应达到平衡时吸热Q kJ,则x=$\frac{2Q}{a}$(用含a、Q的代数式表示).
(4)为了探究温度、固体反应物的表面积对化学反应速率的影响,某同学在一固定容积的密闭容器中加入一定量的重晶石和H2,设计了下表中的三组实验:
| 试验编号 | T/℃ | c起始(H2)/mol•L-1 | 重晶石的比表面积/m2•g-1 |
| Ⅰ | 850 | c1 | 3.4 |
| Ⅱ | T1 | 0.80 | 7.6 |
| Ⅲ | 900 | 0.80 | 7.6 |
②在直角坐标系中画出Ⅰ,Ⅱ两组实验氢气的浓度随时间变化趋势图,并在每条曲线上标明对应的实验编号.
分析 (1)可逆反应到达时,同一物质表示的正、逆反应速率相等(或不同物质表示的正逆速率之比等于其化学计量数之比),各物质的浓度、含量不再发生变化,由此衍生的其它一些物理量不变,选择判断平衡的物理量应随反应进行发生变化,该物理量由变化到不再变化,说明可逆反应到达平衡;
(2)改变条件提高H2的转化率,说明改变条件,平衡向正反应移动,同时又可提高反应速率,再根据外接条件对反应速率、平衡移动影响分析解答;
(3)①在时间t~3t共2tmin内,氢气物质的量变化为1.5mol-0.9mol=0.6mol,由于随反应进行,氢气浓度降低,故t~3t共2tmin内,前tmin内氢气的反应速率大于后tmin内的速率;
②根据氢气转化率计算参加反应氢气物质的量,进而计算平衡时氢气、水的物质的量,反应前后气体的化学计量数相等,用物质的量代替浓度代入平衡常数表达式K=$\frac{{c}^{4}({H}_{2}O)}{{c}^{4}({H}_{2})}$计算;
根据热化学方程式表示出反应放出的热量,进而计算x的值;
(4)①采取控制变量法分析,对比实验Ⅱ、Ⅲ中数据,应是实验对比探究温度对反应速率的影响,对比Ⅰ、Ⅱ数据,应是实验对比探究固体反应物的表面积对反应速率的影响;
②Ⅰ、Ⅱ是固体反应物的表面积度对反应速率影响,固体反应物的表面积越大,反应速率越快,到达平衡时间越短,固体反应物的表面积不影响平衡移动,平衡时氢气的浓度相等;
Ⅱ、Ⅲ是实验对比探究温度对反应速率的影响,温度越高,反应速率越快,到达平衡时间越短,正反应为吸热反应,升高温度平衡向逆反应方向移动,平衡时Ⅲ中氢气浓度小于Ⅱ.
解答 解:(1)a.没有指明正逆反应速率,无法判断是否到达平衡,故a错误;
b.混合气体总物质的量不变,温度、容器容积保持不变,容器内压强始终不变,故b错误;
c.v正(H2)=v逆(H2O)则说明氢气的消耗速率等于其生成速率,反应到达平衡,故c正确;
d.生成物水蒸气的浓度保持不变,说明反应到达平衡,故d正确,
故选:cd;
(2)a.使用催化剂加快反应速率,不影响平衡移动,故a错误;
b.升高反应体系的温度,反应速率加快,正反应为吸热反应,平衡向正反应方向移动,氢气的转化率增大,故b正确;
c.增大反应容器的体积,压强减小,反应速率降低,平衡不移动,氢气转化率不变,故c错误;
d.及时从反应体系中分离出水蒸气,平衡向正反应方向移动,氢气转化率增大,但物质的浓度降低,反应速率减小,故d错误,
故选:b;
(3)①在时间t~3t共2tmin内,氢气物质的量变化为1.5mol-0.9mol=0.6mol,由于随反应进行,氢气浓度降低,故t~3t共2tmin内,前tmin内氢气的反应速率大于后tmin内的速率,故前tmin内氢气的物质的量变化大于0.3mol,故此时氢气物质的量小于1.5mol-0.3mol=1.2mol,
故答案为:<;
②参加反应氢气物质的量为2a mol,则平衡时氢气为2(1-a)mol,由方程式可知生成水为2a mol,反应前后气体的化学计量数相等,用物质的量代替浓度代入平衡常数,故平衡常数K=$\frac{{c}^{4}({H}_{2}O)}{{c}^{4}({H}_{2})}$=$\frac{(2a)^{4}}{[2(1-a)]^{4}}$=$\frac{{a}^{4}}{(1-a)^{4}}$;
反应放出的热量为xkJ×$\frac{2amol}{4mol}$,即xkJ×$\frac{2amol}{4mol}$=Q,故x=$\frac{2Q}{a}$,
故答案为:$\frac{{a}^{4}}{(1-a)^{4}}$;$\frac{2Q}{a}$;
(4)①采取控制变量法分析,对比实验Ⅱ、Ⅲ中数据,应是实验对比探究温度对反应速率的影响,对比Ⅰ、Ⅱ数据,应是实验对比探究固体反应物的表面积对反应速率的影响,故T1=850℃、c1=0.80mol/L,
故答案为:850;0.80;
②Ⅰ、Ⅱ是固体反应物的表面积度对反应速率影响,固体反应物的表面积越大,反应速率越快,到达平衡时间越短,固体反应物的表面积不影响平衡移动,平衡时氢气的浓度相等,
Ⅱ、Ⅲ是实验对比探究温度对反应速率的影响,温度越高,反应速率越快,到达平衡时间越短,正反应为吸热反应,升高温度平衡向逆反应方向移动,平衡时Ⅲ中氢气浓度小于Ⅱ,
故Ⅰ、Ⅱ两组实验氢气的浓度随时间变化趋势图为 ,故答案为:
,故答案为: .
.
点评 本题考查化学平衡状态的判断、化学反应速率及化学平衡影响因素、平衡常数计算、反应热计算等,是对学生综合能力的考查,注意利用控制变量法分析探究影响反应速率的因素.

| A. | 电能是二次能源 | B. | 水力是一次能源 | ||
| C. | 天然气是一次能源 | D. | 蒸汽是一次能源 |
| A. | 硫酸与氢氧化钡在溶液中反应:Ba2++SO42-═BaSO4↓ | |
| B. | 在NaOH溶液中加入醋酸溶液:H++OH-═H2O | |
| C. | 用小苏打治疗胃酸过多:HCO3-+H+═CO2↑+H2O | |
| D. | 向FeI2溶液中通入过量Cl2:2Fe2++Cl2═2Fe3++2Cl- |
| A. | C(Na+)=C(CO32-)+C(HCO3-)+C(OH-) | |
| B. | C(Na+)+C(H+)=C(CO32-)+C(HCO3-)+C(OH-) | |
| C. | C(Na+)+C(H+)=2C(CO32-)+C(HCO3-)+C(OH-) | |
| D. | C(CO32-)+2C(OH-)=3C(H2CO3)+C(HCO3-)+2C(H+) |
| A. |  与 与 互为同系物 互为同系物 | B. | 乙醇和乙醚互为同分异构体 | ||
| C. | 可用溴水来区分苯和苯的同系物 | D. | 乙醇、乙二醇、丙三醇互为同系物 |
| A. | 所含质子数为(A-n) | B. | 所含中子数为(A-Z) | ||
| C. | 所含电子数为(Z+n) | D. | 中子数-电子数=A-2Z-n |
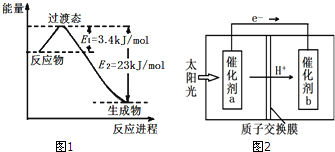 空气中CO2含量偏高会产生温室效应,也会对人体健康造成影响;CO2的用途广泛,合理使用则可缓解由CO2累积所产生的温室效应,实现CO2的良性循环.
空气中CO2含量偏高会产生温室效应,也会对人体健康造成影响;CO2的用途广泛,合理使用则可缓解由CO2累积所产生的温室效应,实现CO2的良性循环.(1)一定条件下CO2可制得Na2CO3、NaHCO3等.
①等物质的量浓度的Na2CO3、NaHCO3溶液,碱性前者>后者(填“>”“<”或“=”).
②有下列五种物质的量浓度均为0.1mol/L的电解质溶液,将其稀释相同倍数时,pH变化最大的是E(填字母编号).
A.Na2CO3B.NaHCO3 C.NaAlO2 D.CH3COONa E.NaOH
(2)已知反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H=a kJ/mol,测得在不同温度下,
该反应的平衡常数K随温度的变化如下:
| 温度(℃) | 300 | 500 | 700 |
| K | 3.00 | 3.47 | 4.40 |
(3)目前工业上可以用CO2和H2在230℃、催化剂条件下反应生成甲醇蒸汽和水蒸气.图1为恒压容器中0.5mol CO2和1.5mol H2反应转化率达80%时的能量变化示意图.则该反应的热化学方程式为:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=-49 kJ/mol.
(4)人工光合作用能够借助太阳能,用CO2和H2O制备化学原料.图2是制备HCOOH的示意图,根据要求回答问题:
①催化剂b表面的电极反应式为CO2+2e-+2H+=HCOOH.
②经测定,若每分钟通过质子交换膜的H+的物质的量为40mol,则每小时可产生O219.2Kg.

