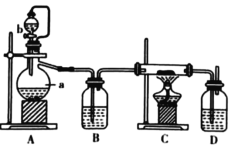
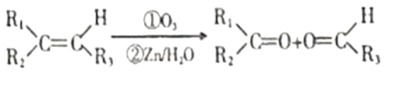题目内容
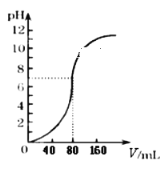
【题目】电解质溶液电导率越大导电能力越强,常温下用0.100 mol/L盐酸分别滴定10.00 mL浓度均为0.100 mol/L的NaOH溶液和氨水。利用传感器测得滴定过程中溶液的电导率如图所示,下列说法不正确的是( )
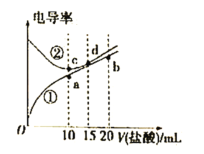
A.曲线②代表滴定氢氧化钠溶液的曲线
B.滴定氨水的过程应该选择甲基橙作为指示剂
C.b点溶液中:c(H+)<c(OH-)+c(NH4+)+c(NH3·H2O)
D.a、b、c、d四点的溶液中,水的电离程度最大的是a点
【答案】C
【解析】
从图中可以看出,在加入盐酸前,曲线②的电导率大,则表明溶液中离子浓度大,曲线②表示NaOH溶液的电导率;曲线①表示氨水的电导率。在两份电解质溶液中,NaOH与一水合氨的物质的量相同,则加入盐酸10mL时刚好完全反应,溶质分别为NaCl和NH4Cl;继续滴加盐酸,则盐酸过量,不发生化学反应。
A.由以上分析知,由于曲线②的电导率强,表明溶液的导电能力强,离子浓度大,从而得出曲线②代表滴定氢氧化钠溶液的曲线,A正确;
B.氨水与盐酸反应的最终产物为NH4Cl,水溶液显酸性,所以应该选择甲基橙作为指示剂,B正确;
C.滴加盐酸至b点时,溶液中n(NH4Cl)=n(HCl),溶液显酸性,根据电荷守恒可知c(H+)+c(NH4+)=c(OH-)+c(Cl-),根据物料守恒可知2c(NH4+)+2c(NH3·H2O)=c(Cl-),因此c(H+)=c(OH-)+c(NH4+)+2c(NH3·H2O),所以c(H+)>c(OH-)+c(NH4+)+c(NH3·H2O),C不正确;
D.a、b、c、d四点的溶液中,a点为NH4Cl溶液,c点为NaCl溶液,d点为NaCl、HCl混合溶液,b点为NH4Cl、HCl混合溶液,所以只有a点水的电离受到促进,水的电离程度最大,D正确;
故选C。

 名校课堂系列答案
名校课堂系列答案