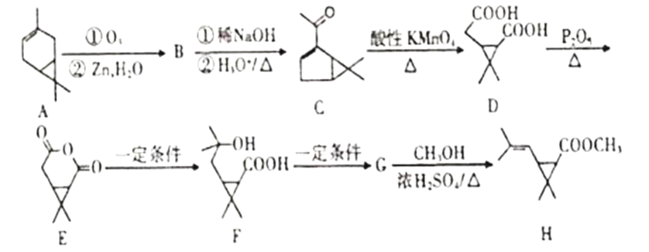
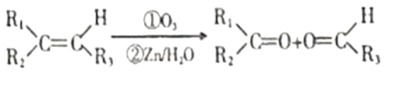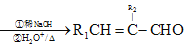题目内容
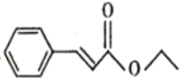
【题目】甲苯(C7H8)和二甲苯(C8H10)是重要的化工原料。利用苯(C6H6)和甲醇(CH3OH)在催化剂作用下反应得到C7H8、C8H10和副产物三甲苯(C9H12),发生的主要反应如下:
Ⅰ.C6H6(g)+CH3OH(g)C7H8(g)+H2O(g)
Ⅱ.C7H8(g)+CH3OH(g)C8H10(g)+H2O(g)
Ⅲ.C8H10(g)+CH3OH(g)C9H12(g)+H2O(g)
(1)500℃、0.18Mpa条件下,反应达到平衡时,结果如图所示。
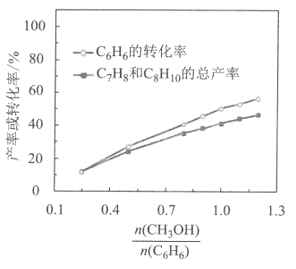
①由图分析,随着投料比![]() 增加,CH3OH的平衡转化率___,平衡时
增加,CH3OH的平衡转化率___,平衡时![]() 的值___。(填“增大”、“减小”或“不变”)
的值___。(填“增大”、“减小”或“不变”)
②投料比![]() 为1.0时,C6H6的平衡转化率为50%,产物中C7H8、C8H10和C9H12物质的量之比为6︰3︰1。CH3OH的平衡转化率为___,反应I的平衡常数K=___。
为1.0时,C6H6的平衡转化率为50%,产物中C7H8、C8H10和C9H12物质的量之比为6︰3︰1。CH3OH的平衡转化率为___,反应I的平衡常数K=___。
(2)我国学者结合实验与计算机模拟结果,研究了反应I在固体酸(HB)催化剂表面进行的反应历程如图所示。其中吸附在固体酸(HB)表面的物种用*标注。
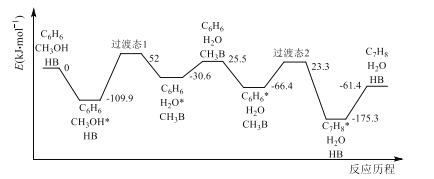
①反应I的H=___kJ·mol-1。
②吸附CH3OH的焓变___吸附C6H6的焓变(填“>”或“<”)。
③C6H6*在催化剂表面转化为C7H8*的反应方程式为___。
④在固体酸(HB)催化作用下,测得反应I的速率方程为v=kp(C6H6)(k为速率常数)。在刚性容器中发生反应I,关于反应I的平衡常数(K)和反应速率(v)的叙述正确的是__(填标号)。
A.升高温度,K和v均增大
B.增大p(C6H6),K不变,v增大
C.降低温度,K和v均减小
D.增大p(CH3OH),K不变,v增大
【答案】减小 增大 75% 1.8 -61.4 < C6H6*+H2O+CH3B=C7H8*+H2O+HB B
【解析】
(1)①由图分析,随着投料比![]() 增加,苯(C6H6)的转化率在增加,CH3OH的物质的量在增加,平衡转化率减小,根据平衡移动的方向判断平衡时
增加,苯(C6H6)的转化率在增加,CH3OH的物质的量在增加,平衡转化率减小,根据平衡移动的方向判断平衡时![]() 的值的变化;
的值的变化;
②设当设C6H6的平衡转化率为50%,产物中C7H8、C8H10和C9H12物质的量分别为6mol、3mol、1mol,则反应ⅢC8H10(g)+CH3OH(g)C9H12(g)+H2O(g)中平衡时,C8H10和C9H12的物质的量分别为3mol、1mol,则反应Ⅲ中C8H10(g)的初始投料为4mol,即平衡时反应ⅡC7H8(g)+CH3OH(g)C8H10(g)+H2O(g)平衡时,C7H8、C8H10的物质的量分别为6mol和4mol,则反应Ⅱ中C7H8初始量为10mol,即平衡时反应ⅠC6H6(g)+CH3OH(g)C7H8(g)+H2O(g)中C7H8(g)平衡时的物质的量为10mol,则反应ⅠC6H6(g)和CH3OH(g)的转化量为10mol,根据投料比![]() 为1.0时,设C6H6的平衡转化率为50%,则反应Ⅰ中C6H6(g)和CH3OH(g) 的初始投入量相等,都为20mol,据此列三段式计算解答;
为1.0时,设C6H6的平衡转化率为50%,则反应Ⅰ中C6H6(g)和CH3OH(g) 的初始投入量相等,都为20mol,据此列三段式计算解答;
(2)①结合反应I的方程式:C6H6(g)+CH3OH(g)C7H8(g)+H2O(g),根据图示,利用盖斯定律解答;
②根据图示中,吸附CH3OH的焓变和吸附C6H6的焓变数值进行比较判断;
③根据图示,找到C6H6*和C7H8*所在的位置书写反应方程式;
④根据①中分析可知,反应I的方程式为:C6H6(g)+CH3OH(g)C7H8(g)+H2O(g),正反应为放热反应;该体系反应前后气体分子数目不变,平衡常数只与温度有关,温度不变平衡常数不变,结合外界条件对反应速率的影响分析判断速率的变化。
(1)①由图分析,随着投料比![]() 增加,苯(C6H6)的转化率在增加,CH3OH的物质的量在增加,平衡转化率减小;根据图像,结合三个反应,苯(C6H6)的转化率与C7H8、C8H10和C9H12三种产物的产量成正比关系,图像中苯(C6H6)的转化率与C7H8、C8H10的产量之差,应为C9H12的产量,根据图显示,C9H12的产量在增大,则
增加,苯(C6H6)的转化率在增加,CH3OH的物质的量在增加,平衡转化率减小;根据图像,结合三个反应,苯(C6H6)的转化率与C7H8、C8H10和C9H12三种产物的产量成正比关系,图像中苯(C6H6)的转化率与C7H8、C8H10的产量之差,应为C9H12的产量,根据图显示,C9H12的产量在增大,则![]() 的值增大;
的值增大;
②设C6H6的平衡转化率为50%,产物中C7H8、C8H10和C9H12物质的量分别为6mol、3mol、1mol,则反应ⅢC8H10(g)+CH3OH(g)C9H12(g)+H2O(g)中平衡时,C8H10和C9H12的物质的量分别为3mol、1mol,则反应Ⅲ中C8H10(g)的初始投料为4mol,即平衡时反应ⅡC7H8(g)+CH3OH(g)C8H10(g)+H2O(g)平衡时,C7H8、C8H10的物质的量分别为6mol和4mol,则反应Ⅱ中C7H8初始量为10mol,即平衡时反应ⅠC6H6(g)+CH3OH(g)C7H8(g)+H2O(g)中C7H8(g)平衡时的物质的量为10mol,则反应ⅠC6H6(g)和CH3OH(g)的转化量为10mol,根据投料比![]() 为1.0时,设C6H6的平衡转化率为50%,则反应Ⅰ中C6H6(g)和CH3OH(g) 的初始投入量相等,都为20mol,据此列三段式可得:
为1.0时,设C6H6的平衡转化率为50%,则反应Ⅰ中C6H6(g)和CH3OH(g) 的初始投入量相等,都为20mol,据此列三段式可得:
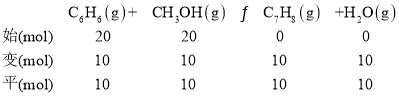
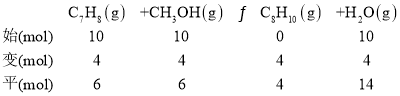

根据以上转化后,平衡时CH3OH剩余5mol,则CH3OH平衡转化率为![]() ×100%=75%,反应I体系中各物质反应计量系数都为1,则物质的量的变化量可代表浓度变化量,体系平衡时,CH3OH物质的量为5mol,C6H6的物质的量为10mol,C7H8的物质的量为6mol,水蒸气的物质的量为15mol,则平衡常数K=
×100%=75%,反应I体系中各物质反应计量系数都为1,则物质的量的变化量可代表浓度变化量,体系平衡时,CH3OH物质的量为5mol,C6H6的物质的量为10mol,C7H8的物质的量为6mol,水蒸气的物质的量为15mol,则平衡常数K=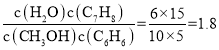 ;
;
(2)①反应I的方程式为:C6H6(g)+CH3OH(g)C7H8(g)+H2O(g),根据图示,反应物的总能量高于生成物的总能量,为放热反应,利用盖斯定律,反应热只与始态和终态有关,与反应过程无关,则H=-61.4kJ·mol-1;
②根据图示,吸附CH3OH的焓变为-109.9 kJ·mol-1,吸附C6H6的焓变为-66.4 kJ·mol-1,二者焓变都小于0,则吸附CH3OH的焓变<吸附C6H6的焓变;
③根据图示,C6H6*在催化剂表面转化为C7H8*的反应方程式为C6H6*+H2O+CH3B=C7H8*+H2O+HB;
④根据①中分析可知,反应I的方程式为:C6H6(g)+CH3OH(g)C7H8(g)+H2O(g),正反应为放热反应;该体系反应前后气体分子数目不变,
A.升高温度,平衡逆向移动,则K减小,升高温度反应速率v增大,故A错误;
B.平衡常数只与温度有关,温度不变,平衡常数K不变,增大p(C6H6),根据v=kp(C6H6),则反应v增大,故B正确
C.降低温度,平衡向正向移动,平衡常数K增大,降温反应速率v减小,故C错误;
D.平衡常数只与温度有关,温度不变,平衡常数K不变,增大p(CH3OH),体系中各组分的压强都增大,反应速率v增大,故D错误;
答案选B。

 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案【题目】阅读短文,回答问题。
燃放烟花爆竹是我国的传统习俗,烟花爆竹的主要成分有黑火药、特效药剂等。

黑火药由硝酸钾(KNO3)、硫黄(S)和木炭组成,
燃烧时,瞬间产生大量气体,同时释放大量热,在有限的空间里,气体受热迅速膨胀引起爆炸。特效药剂常含一些金属元素,燃烧时会产生五彩缤纷的火焰。(如右图所示)
下表为几种金属元素的化合物燃烧时的火焰颜色:
所含金属元素 | 钠 | 钙 | 钡 | 铯 |
火焰颜色 | 黄 | 砖红色 | 黄绿 | 蓝 |
然而,传统的烟花爆竹不仅会污染环境,也会造成各种伤残及火灾事故。为了改善传统烟花爆竹的不足,又能为人们的佳节祝兴,电子鞭炮应运而生。目前,常见的电子鞭炮有三种形式。
第一,雷电式仿真电子鞭炮,不仅能发出普通鞭炮的模拟声,而且还能发出闪光,以假乱真。无火药、无污染,不会发生伤残及火灾事故。能重复使用,大大减少经济支出。其局限性是需要使用家用电源,不方便移动。
第二,电子鞭炮机,是一种使用煤气和氧气混合气体作为燃料的设备,声响大,与火药鞭炮无异,但缺陷是点燃混合气体时存在一定的安全隐患。
第三,录音鞭炮,通过音频解码播放存储于芯片中的鞭炮录音,声音与功率大小有关。这种鞭炮的优点是纯电能、可移动、造价低廉。缺点是仿真和氛围感度稍差。
新型电子鞭炮正在不断地被研发出来,更好地促进民俗与科技的融合。
依据上文,回答问题:
(1)若燃放烟花的火焰呈现黄绿色,则烟花中可能含有______元素。
(2)雷电式仿真电子鞭炮的优点有______(填序号)。
A.无火药、无污染
B.不会发生伤残及火灾事故
C.能重复使用,减少经济支出
(3)判断下列说法是否正确(填“对”或“错”)。
①燃放烟花爆竹时产生不同颜色的火焰,是因为药剂中含有不同的金属元素。______
②燃放烟花爆竹后会闻到刺激性的气味,是因为生成了二氧化碳。______
③电子鞭炮机在点燃混合气体时存在一定的安全隐患。______
④录音鞭炮的声音大小与功率无关。______
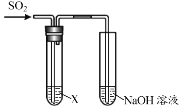
【题目】某学习小组用下图装置研究SO2的性质。
| 序号 | X | 实验现象 |
Ⅰ | 紫色石蕊溶液 | 现象a | |
Ⅱ | 品红溶液 | 溶液由红色变为无色,加热后又恢复原来的颜色 | |
Ⅲ | 酸性KMnO4溶液 | 溶液由紫色变为无色 |
请回答:
(1)实验Ⅰ中,现象a是______。
(2)根据实验Ⅱ,推断SO2的化学性质是______。
(3)根据实验Ⅲ,推断无色溶液中所含的离子是K+、Mn2+、H+和______。
(4)结合离子方程式说明实验中NaOH溶液的作用是______。