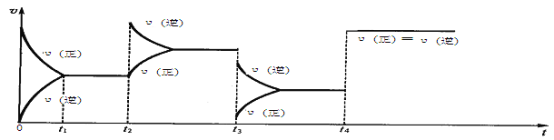
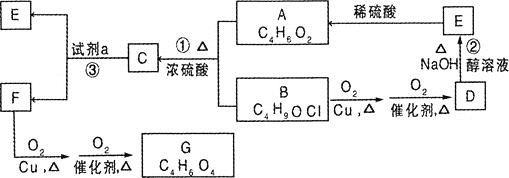
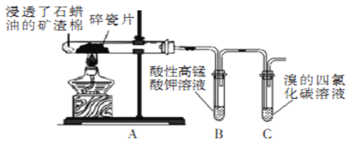
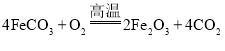题目内容
【题目】将7g铁粉投入400mL1mol/LHNO3溶液中,还原产物为NO。若反应后溶液的体积不变,下列说法错误的是( )
A.生成气体在标准状况下为2.24L
B.反应后溶液中c(Fe3+)=0.125mol/L
C.反应后的溶液再投入2.8g铁粉可全部溶解
D.反应后溶液中c(NO3-)=0.75mol/L
【答案】C
【解析】
Fe与稀HNO3可能发生的反应有:Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O、3Fe+8HNO3(稀)=3Fe(NO3)2+2NO↑+4H2O,n(Fe)=![]() =0.125mol,n(HNO3)=1mol/L×0.4L=0.4mol,n(Fe):n(HNO3)=0.125mol:0.4mol=1:3.2,可见Fe与稀HNO3完全反应生成Fe(NO3)3和Fe(NO3)2,硝酸完全反应,而
=0.125mol,n(HNO3)=1mol/L×0.4L=0.4mol,n(Fe):n(HNO3)=0.125mol:0.4mol=1:3.2,可见Fe与稀HNO3完全反应生成Fe(NO3)3和Fe(NO3)2,硝酸完全反应,而![]() 的硝酸只有
的硝酸只有![]() 被还原,所以生成一氧化氮的物质的量为:
被还原,所以生成一氧化氮的物质的量为:![]() ,反应生成的铁离子和亚铁离子的物质的量分别为xmol和ymol,
,反应生成的铁离子和亚铁离子的物质的量分别为xmol和ymol,
则![]() ;解之得:
;解之得:![]() ;
;
A.生成气体在标准状况下为![]() ,故A正确;
,故A正确;
B.反应后溶液中Fe3+的浓度![]() ,故B正确;
,故B正确;
C.根据铁离子与单质铁反应生成亚铁离子,![]() 的铁离子得到
的铁离子得到![]() 的电子,消耗
的电子,消耗![]() 的铁,所以可溶解铁粉的质量为
的铁,所以可溶解铁粉的质量为![]() ,故C错误;
,故C错误;
D.反应后溶液中![]() ,故D正确;
,故D正确;
故选C。

【题目】(Ⅰ)已知在448℃时,反应H2(g)+I2(g)![]() 2HI(g)的平衡常数K1为49,则该温度下反应2HI(g)
2HI(g)的平衡常数K1为49,则该温度下反应2HI(g)![]() H2(g)+I2(g)的平衡常数K2为___;
H2(g)+I2(g)的平衡常数K2为___;
(Ⅱ)在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
t/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=___。
(2)该反应为___反应(填“吸热”或“放热”)。
(3)能判断该反应达到化学平衡状态的依据是___。
A.容器中压强不变 B.混合气体中C(CO)不变
C.V(H2)正=V(H2O)逆 D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:C(CO2)C(H2)=c(CO)c(H2O),判断此时温度为___℃。
【题目】工业上从电解精炼铜的阳极泥(成分为CuS、Cu2Se、Cu2Te 和少量金属单质Au) 中回收碲、硒的工艺流程如下:
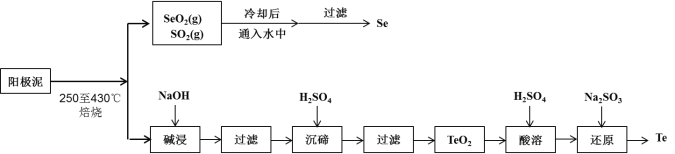
已知:①TeO2是两性氧化物。
②Se和TeO2的物理性质如下:
物理性质 | 熔点 | 沸点 | 水溶性 |
Se | 221℃ | 685℃ | 难溶于水 |
TeO2 | 733℃ | 1260℃ | 微溶于水 |
(1)Se在周期表中的位置为____________。
(2)SeO2与SO2的混合烟气可用水吸收制得单质Se,当有2 mol电子转移时,会生成______mol Se。过滤所得粗硒可采用真空蒸馏的方法提纯获得纯硒,采用真空蒸馏的目的是_______________。
(3)“碱浸”过滤得到滤渣的主要成分是_______(填化学式)。
(4)“沉碲”时控制溶液的pH为4.5-5.0,生成TeO2沉淀。如果H2SO4的浓度过大,将导致“沉碲”不完全,原因为_______________________________________。
(5)“酸溶”将TeO2先溶于硫酸得到Te(SO4)2,然后加入Na2SO3溶液进行还原,还原碲的离子反应方程式是_______________________________________。
(6)常温下,SeO2与NaOH溶液反应所得NaHSeO3溶液的pH______7(填“>”“<”或“=”),请通过计算说明_____________________________。(已知25℃时,亚硒酸(H2SeO3)的Ka1=2.5×10-3,Ka2=2.5×10-7)