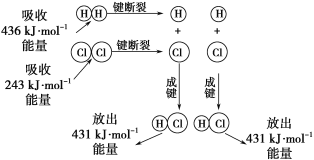
题目内容
【题目】某研究小组探究石蜡油裂解产物,设计如图实验。下列说法正确的是
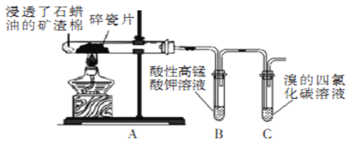
A.实验完毕后先熄灭酒精灯后拆导管
B.两支试管中发生的反应类型相同
C.可观察到B和C试管中液体褪色和分层
D.本实验能证明其产物含有碳碳不饱和键
【答案】D
【解析】
石蜡油(液态烷烃的混合物)在碎瓷片催化作用下反应的生成物中含有烯烃和烷烃;生成物中含有烯烃,通入酸性高锰酸钾溶液后,发生了氧化反应,可以使酸性高锰酸钾溶液褪色;通入溴的四氯化碳溶液中,发生加成反应,溶液褪色,据此解答。
A.为防止倒吸,实验完毕后应该先拆导管后熄灭酒精灯,故A错误;
B.由于石蜡油的裂解产物中含有不饱和烃,所以B试管中发生的是氧化反应,C试管中发生的是加成反应,反应类型不同,故B错误;
C.石蜡油(液态烷烃的混合物)在碎瓷片催化作用下反应的生成物中含有烯烃和烷烃,烷烃不能与酸性高锰酸钾溶液反应而浮在液面上,烯烃与酸性高锰酸钾溶液发生氧化反应,所以实验时可观察到B试管中液体逐渐褪色和分层,烯烃与溴的四氯化碳溶液发生加成反应生成溴代烃,根据相似相溶原理可知,溴代烃和不反应的烷烃都能溶于四氯化碳,C试管中液体褪色,不分层,故C错误;
D.碳碳不饱和键能够使酸性高锰酸钾溶液和溴的四氯化碳溶液褪色,所以本实验能证明其产物含有碳碳不饱和键,故D正确;
答案选D。

【题目】(1)请用下列10种物质的序号填空:①O2②H2③NH4NO3④K2O2⑤Ba(OH)2⑥CH4⑦CO2⑧NaF ⑨NH3⑩I2
既有离子键又有非极性键的是________;既有离子键又有极性键的是________。
(2)X、Y两种主族元素能形成XY2型化合物,已知XY2中共有38个电子,若XY2为常见元素形成的离子化合物,其电子式为:______________;若XY2为共价化合物时,其结构式为:__________________。
(3)氯化铝的物理性质非常特殊,如:氯化铝的熔点为190℃(2.02×103Pa),但在180℃就开始升华,据此判断,氯化铝是________(填“共价化合物”或“离子化合物”),可以证明你的判断正确的实验依据是____________________。
(4)现有a~g 7种短周期元素,它们在周期表中的位置如下,请据此回答下列问题:

①元素的原子间反应最容易形成离子键的是________(填序号,下同),容易形成共价键的是______;
A.c和f | B.b和g | C.d和g | D.b和e |
②写出a~g 7种元素形成的所有原子都满足最外层为8电子结构的任意一种分子的分子式______。
【题目】实验室用卤块(主要成分为MgCl2·6H2O,含有MgSO4.FeCl2等杂质)制备少量Mg(ClO3)2·6H2O的流程如下:
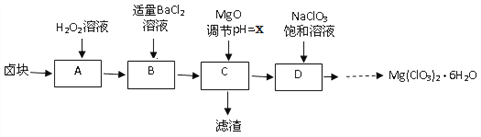

已知:①四种化合物的溶解度(S)随温度(T)变化曲线如图所示。
②室温时一些物质的Ksp如下表:
化学式 | Fe(OH)2 | Fe(OH)3 | Mg(OH)2 |
Ksp | 8.0×10-16 | 8.0×10-38 | 1.8x10-11 |
③Mg(ClO3)2有较强的氧化性,其还原产物是Cl-.
(1)H2O2的电子式为_________
(2)滤渣的成分是____________(填化学式);
(3)经测定,D中铁离子的浓度为1×10-5 mol/L,则x为______
(4)D中所发生的化学反应方程式为_____,框图中由D→......→制Mg(ClO3)2·6H2O晶体的实验步骤依次为:①加热蒸发;②_______(请补充);③冷却结晶;④过滤洗涤。
(5)产品中Mg(ClO3)2·6H2O含量的测定:
步骤1:准确称量3.50 g产品配成100 mL溶液。
步骤2:取10.00 mL试液于锥形瓶中,加入10.00 mL稀硫酸和20 .00mL 1.000 mol/L的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100 mol/L K2Cr2O7溶液滴定剩余的Fe2+至终点。
步骤4:将步骤2、3重复两次
①步骤3中发生反应的离子方程式____________
②步骤3中若滴定前不用标准液润洗滴定管,将会导致最终结果_____(填“偏大”. “偏小”或“不变”)。
③若平均消耗K2Cr2O7溶液15.00 mL,则产品中Mg(ClO3)2·6H2O(其M=299g/mol)的质量分数为___________