题目内容
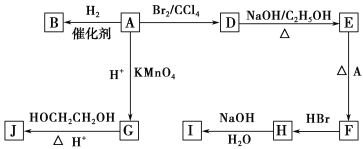
【题目】工业上从电解精炼铜的阳极泥(成分为CuS、Cu2Se、Cu2Te 和少量金属单质Au) 中回收碲、硒的工艺流程如下:
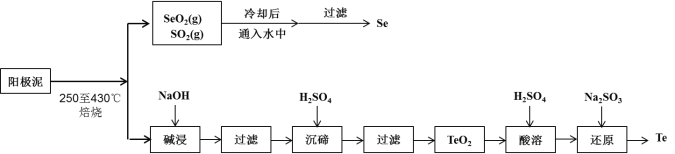
已知:①TeO2是两性氧化物。
②Se和TeO2的物理性质如下:
物理性质 | 熔点 | 沸点 | 水溶性 |
Se | 221℃ | 685℃ | 难溶于水 |
TeO2 | 733℃ | 1260℃ | 微溶于水 |
(1)Se在周期表中的位置为____________。
(2)SeO2与SO2的混合烟气可用水吸收制得单质Se,当有2 mol电子转移时,会生成______mol Se。过滤所得粗硒可采用真空蒸馏的方法提纯获得纯硒,采用真空蒸馏的目的是_______________。
(3)“碱浸”过滤得到滤渣的主要成分是_______(填化学式)。
(4)“沉碲”时控制溶液的pH为4.5-5.0,生成TeO2沉淀。如果H2SO4的浓度过大,将导致“沉碲”不完全,原因为_______________________________________。
(5)“酸溶”将TeO2先溶于硫酸得到Te(SO4)2,然后加入Na2SO3溶液进行还原,还原碲的离子反应方程式是_______________________________________。
(6)常温下,SeO2与NaOH溶液反应所得NaHSeO3溶液的pH______7(填“>”“<”或“=”),请通过计算说明_____________________________。(已知25℃时,亚硒酸(H2SeO3)的Ka1=2.5×10-3,Ka2=2.5×10-7)
【答案】四周期,第VIA族 0.5 降低Se的沸点,避免 Se与空气中氧气发生反应 CuO,Au 硫酸浓度过大, TeO2会溶于酸,导致 TeO2沉淀不完全 Te4++2SO32- +2H2O===2SO42-+Te↓+4H+ < HSeO3-的水解常数Kh=4.0×10-12,由于 Kh<Ka2,故NaHSeO3 溶液的 pH<7
【解析】
电解精炼铜的阳极泥主要成分为CuS、Cu2Se、Cu2Te和少量金属单质Au,高温焙烧得SeO2和SO2混合气体,气体冷却后通入冷水中发生反应生成Se和硫酸,经过滤得到Se;剩余固体用NaOH溶解其中两性氧化物TeO2,经过滤得Na2TeO3水溶液,用稀硫酸酸化并过滤后可得到TeO2沉淀,此沉淀再溶于稀硫酸溶解,再滴加Na2SO3溶液,可将溶液中的Te4+还原为Te。
(1)根据原子结构可知Se在周期表中的位置为四周期,第VIA族。本小题答案为:四周期,第VIA族。
(2)+4价Se的氧化性强于+4价S的氧化性,SeO2、SO2的混合气体用水吸收得到H2SO4、Se,反应的化学方程式为![]() 。由化学反应方程式可知每转移4mol电子生成1mol的Se,则转移2mol电子生成0.5mol的Se。Se的沸点为685°C,还原性强于S,采用真空蒸馏的方法提纯硒,不仅可以降低Se的沸点,也可以避免Se与空气中的O2发生反应。本小题答案为:0.5;降低Se的沸点,避免 Se与空气中氧气发生反应 。
。由化学反应方程式可知每转移4mol电子生成1mol的Se,则转移2mol电子生成0.5mol的Se。Se的沸点为685°C,还原性强于S,采用真空蒸馏的方法提纯硒,不仅可以降低Se的沸点,也可以避免Se与空气中的O2发生反应。本小题答案为:0.5;降低Se的沸点,避免 Se与空气中氧气发生反应 。
(3)阳极泥中的CuS、Cu2Se、Cu2Te在高温焙烧过程中,会与O2反应转化为CuO、SO2、SeO2、TeO2,Au不反应,加入NaOH“碱浸”时,CuO、Au不与NaOH溶液反应,TeO2溶解在NaOH溶液中,所以得到的滤渣的主要成分为CuO、Au。本小题答案为:CuO、Au。
(4)根据题目信息,TeO2是两性氧化物,能与H2SO4反应,如果H2SO4的浓度过大,即H2SO4过量,“沉碲”得到的TeO2继续与H2SO4反应而导致损失。本小题答案为:硫酸浓度过大, TeO2会溶于酸,导致 TeO2沉淀不完全。
(5)溶液中的Te4+具有较强的氧化性,加入还原性较强的SO32-,二者发生反应生成SO42-和Te单质,其离子方程式为![]() ,本小题答案为:
,本小题答案为:![]() 。
。
(6)NaHSeO3溶液中,HSeO3-既能水解,又能电离,比较水解和电离能力大小即可判断溶液的酸碱性,若电离能力大于水解能力,溶液呈酸性,若水解能力大于电离能力,溶液呈碱性,HSeO3-的水解平衡常数![]() <
<![]() ,故NaHSeO3溶液呈酸性,pH<7,本小题答案为:<;HSeO3-的水解常数Kh=4.0×10-12,由于 Kh<Ka2,故NaHSeO3 溶液的 pH<7。
,故NaHSeO3溶液呈酸性,pH<7,本小题答案为:<;HSeO3-的水解常数Kh=4.0×10-12,由于 Kh<Ka2,故NaHSeO3 溶液的 pH<7。