题目内容
【题目】氮是植物体内蛋白质、叶绿素的重要组成元素,氮肥能促进农作物的生长。氨是生成氮肥的原料。回答下列问题:
(1)氮气的电子式________________ ,氨的结构式__________________;
(2)氨水显碱性,写出氨水的电离方程式___________________________________________;
(3)氨催化氧化生成NO是工业制硝酸的反应之一,写出该反应的化学方程式:________________________________________________。
【答案】![]()
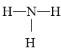 NH3·H2O
NH3·H2O![]() NH4++OH- 4NH3+5O2
NH4++OH- 4NH3+5O2![]() 4NO+6H2O
4NO+6H2O
【解析】
⑴氮气是共用三个电子,其电子式为![]() ,故答案为
,故答案为![]() ;氨的结构式中有三个氮氢键,其结构式为
;氨的结构式中有三个氮氢键,其结构式为![]() ,故答案为:
,故答案为:![]() ;
;
⑵氨水显碱性,氨水电离出氢氧根离子和铵根离子,其的电离方程式NH3·H2O![]() NH4++OH-,故答案为:NH3·H2O
NH4++OH-,故答案为:NH3·H2O![]() NH4++OH-;
NH4++OH-;
⑶氨催化氧化生成NO是工业制硝酸的反应之一,写出该反应的化学方程式:4NH3+5O2![]() 4NO+6H2O,故答案为:4NH3+5O2
4NO+6H2O,故答案为:4NH3+5O2![]() 4NO+6H2O。
4NO+6H2O。

【题目】CO、H2、CH3OH均是清洁能源。
(1)已知部分化学键键能数据如下:
化学键 | C | O=O | C=O | C-O |
E/(kJ mol-1) | 958.5 | 497 | 745 | 351 |
2CO(g) +O2(g)==2CO2(g) ![]() H1 H2O(g)+CO(g)==H2(g) + CO2(g)
H1 H2O(g)+CO(g)==H2(g) + CO2(g) ![]() H2 = -41 kJmol-1
H2 = -41 kJmol-1
CH3OH(g)+ 3/2O2(g)==CO2(g)+2H2O(g) ![]() H3 = -660kJmol-1
H3 = -660kJmol-1
则△H1=_____ kJmol-1,反应CO(g)+2H2(g)![]() CH3OH(g)的△H=_____ kJmol-1。
CH3OH(g)的△H=_____ kJmol-1。
(2)一定条件下,在容积为2 L的密闭容器Q中充入a mol CO与b molH2合成甲醇:CO(g) +2H2(g) ![]() CH3OH(g)。测得平衡时混合气体中CH3OH的体积百分含量与温度、 压强之间的关系如图1所示,图2表示在一定温度下,H2的平衡转化率与反应开始时两种反应物的投料物质的量之比(用X表示)、压强之间的关系。
CH3OH(g)。测得平衡时混合气体中CH3OH的体积百分含量与温度、 压强之间的关系如图1所示,图2表示在一定温度下,H2的平衡转化率与反应开始时两种反应物的投料物质的量之比(用X表示)、压强之间的关系。

①压强相同时,温度为T1、T2时,反应达到平衡所需要的时间分别为t1、t2,则二者之间的相对大小为t1___ t2(填“>”、“<”、“=”或“无法确定”)。
②P1_____P2(填“>”、“<”、“=”或“无法确定”)。
③若a =2,b=4,则压强为P1、温度为T1时该反应的平衡常数K=______________。
④若在压强为P1、温度为T1时,向Q容器中同时加入等物质的量的CO、H2、CH3OH三种气体,则反应开始时,v(CH3OH)正_____v(CH3OH)逆(填“>”、“<”、“=”或“无法确定”)。
【题目】四氯化锡可用作媒染剂。利用如图装置可以制备四氯化锡(部分夹持装置已略去)。

有关信息如下表:
化学式 |
|
|
摩尔质量( | 190 | 261 |
熔点 | 246 | -33 |
沸点 | 652 | 144 |
其他性质 | 无色晶体,易氧化 | 无色液体,易水解 |
回答下列问题:
(1)装置甲中仪器![]() 的名称为_____________。
的名称为_____________。
(2)用装置甲制取氯气,![]() 被还原为
被还原为![]() ,该反应的离子方程式为___________。
,该反应的离子方程式为___________。
(3)将如图装置连接好,先检查装置气密性,再慢慢滴入浓盐酸,待观察到___________(填现象)后,开始加热装置丁,锡熔化后适当增大氯气流量,继续加热装置丁,此时继续加热装置丁的目的是:①促进氯气与锡反应;②_________________________。
(4)如果缺少装置乙,可能发生的副反应的化学方程式为_______________;装置己的作用是______(填字母代号)。
A.除去未反应的氯气,防止污染空气
B.防止空气中![]() 气体进入装置戊
气体进入装置戊
C.防止水蒸气进入装置戊的试管中使产物水解
D.防止空气中![]() 进入装置戊的试管中使产物氧化
进入装置戊的试管中使产物氧化
(5)某同学认为丁装置中的反应可能产生![]() 杂质,以下试剂中可用于检测是否产生
杂质,以下试剂中可用于检测是否产生![]() 的是______(填字母代号)。
的是______(填字母代号)。
A. ![]() 溶液 B.
溶液 B. ![]() 溶液(滴有
溶液(滴有![]() 溶液) C.
溶液) C. ![]() 溶液
溶液
(6)反应中用去锡粒![]() ,反应后在戊装置的试管中收集到
,反应后在戊装置的试管中收集到![]() ,则
,则![]() 的产率为_____(保留3位有效数字)。
的产率为_____(保留3位有效数字)。