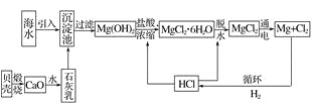
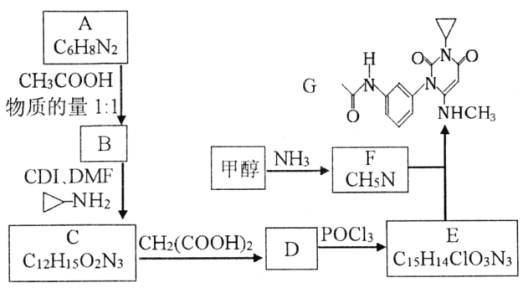
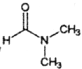
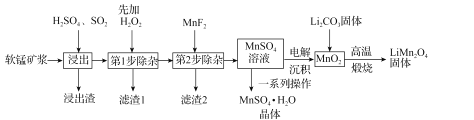
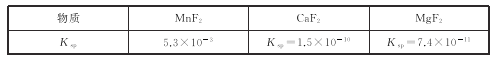
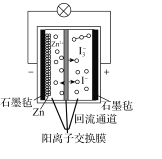
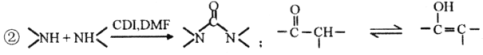题目内容
【题目】研究氮及其化合物对化工生产有重要意义。
(1)已知:
①N2(g)+O2(g)=2NO(g) △H1
②2NH3(g)![]() N2(g)+3H2(g) △H2
N2(g)+3H2(g) △H2
③2H2(g)+O2(g)=2H2O(g) △H3
则热化学方程式:4NH3(g)+6NO(g)=5N2(g)+6H2O(g)△H=_____(用△H1,△H2,△H3表示)。
(2)在2L密闭绝热容器中,投入4molN2和6molH2,在一定条件下生成NH3,测得不同温度下,平衡时NH3的物质的量数据如下表:
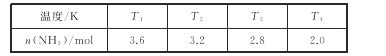
①下列能说明该反应已达到平衡状态的是_____。
A.3v正(H2)=2v逆(NH3)
B.容器内气体压强不变
C.混合气体的密度不变
D.混合气的温度保持不变
②温度T1_____(填“>”<”或“=”)T3。
③在T4温度下,达到平衡时N2的转化率为_____。
(3)N2O4为重要的火箭推进剂之一。N2O4与NO2转换的热化学方程式为N2O4(g)=2NO2(g) △H。上述反应中,正反应速率v正=k正·p(N2O4),逆反应速率v逆=k逆·p2(NO2),其中k正、k逆为速率常数,则该反应的化学平衡常数Kp为____(以k正、k逆表示)。若将一定量N2O4投入真空容器中恒温恒压分解(温度298K、压强110kPa),已知该条件下k逆=5×102kPa-1·s-1,当N2O4分解10%时,v逆=_____kPa·s-1。
(4)以连二亚硫酸盐(S2O42-)为还原剂脱除烟气中的NO,并通过电解再生,装置如图。阴极的电极反应式为_____,电解槽中的隔膜为_____(填“阳”或“阴”)离子交换膜。每处理1molNO,电路中通过电子的物质的量为_____。
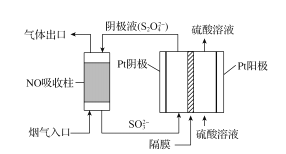
【答案】2△H2+3△H3-3△H1 BD < 25% ![]() 2×105 2SO32-+4H++2e-=S2O42-+2H2O 阳 2mol
2×105 2SO32-+4H++2e-=S2O42-+2H2O 阳 2mol
【解析】
(1)运用盖斯定律计算;
(2)①达到化学平衡时,正逆反应速率相同,各组分浓度保持不变及其衍生的各种关系符合平衡标志;
②反应放热,根据进行方向判断;
③根据三段式进行求解;
(3) 根据v正=v逆,得出Kp,再根据题给已知计算平衡时NO2的分压,然后计算逆反应速率;
(4)阴极上亚硫酸根离子得电子生成S2O42-;阳极上水失电子生成氧气和氢离子,右侧多余的氢离子通过离子交换膜进入左侧,利用氧化还原规律,进行计算求解。
(1)根据盖斯定律①N2(g)+O2(g)=2NO(g) △H1,②2NH3(g)![]() N2(g)+3H2(g) △H2,③2H2(g)+O2(g)=2H2O(g) △H3,将2x②+3x③-3x①得到热化学方程式:4NH3(g)+6NO(g)=5N2(g)+6H2O(g) △H=2△H2+3△H3-3△H1,故答案为:2△H2+3△H3-3△H1;
N2(g)+3H2(g) △H2,③2H2(g)+O2(g)=2H2O(g) △H3,将2x②+3x③-3x①得到热化学方程式:4NH3(g)+6NO(g)=5N2(g)+6H2O(g) △H=2△H2+3△H3-3△H1,故答案为:2△H2+3△H3-3△H1;
(2) N2(g) + 3H2(g)![]() 2NH3(g) △H<0 , ①A.NH3、H2表示的正、逆反应速率比不等于化学计量数之比,不能说明反应达到平衡状态,A项错误;
2NH3(g) △H<0 , ①A.NH3、H2表示的正、逆反应速率比不等于化学计量数之比,不能说明反应达到平衡状态,A项错误;
B.该反应是气体体积减小的反应,建立平衡的过程中气体物质的量减小,容器内压强减小,故当容器内压强不变时,已达到平衡,B项正确;
C.建立平衡过程中气体质量不变,混合气体的密度一直不变,密度不能说明反应达到平衡状态,C项错误;
D.该反应为放热反应,绝热容器温度不变时,已经达到平衡;D项正确;故答案为BD;
②反应放热,温度升高,平衡逆向进行,生成的氨气的物质的量会减小, T1时氨气的物质的量更多,所以温度低,温度T1<T3,故答案为:<;
③根据三段式进行求解法: ,则N2的转化率=
,则N2的转化率=![]() ,故答案为:25%;
,故答案为:25%;
(3)上述反应中,正反应速率v正=k正·p(N2O4),逆反应速率v逆=k逆·p2(NO2),其中k正、k逆为速率常数,v正=v逆,则Kp=![]() ;若将一定量N2O4投入真空容器中恒温恒压分解(温度298K、压强110kPa),已知该条件下k逆=5×102kPa-1·s-1,当N2O4分解10%时,假设开始有1mol N2O4分解0.1mol,生成0.2mol NO2,
;若将一定量N2O4投入真空容器中恒温恒压分解(温度298K、压强110kPa),已知该条件下k逆=5×102kPa-1·s-1,当N2O4分解10%时,假设开始有1mol N2O4分解0.1mol,生成0.2mol NO2,![]() ,故答案为:
,故答案为:![]() ;2×105;
;2×105;
(4)阴极上亚硫酸根离子得电子生成S2O42-,电极反应式为2SO32-+4H++2e-=S2O42-+2H2O;阳极上,水失电子生成氧气和氢离子,右侧多余的氢离子通过离子交换膜进入左侧,所以交换膜为阳离子交换膜;NO吸收转化后的主要产物为N2,消耗1mol NO转移2mol电子,所以电路中转移电子为2mol,故答案为:2SO32-+4H++2e-=S2O42-+2H2O;阳;2mol。

【题目】用活性炭还原处理氮氧化物,有关反应为C(s)+2NO(g) ![]() N2(g)+CO2(g)。
N2(g)+CO2(g)。
(1)写出上述反应的平衡常数表达式_______________。
(2)在2L恒容密闭器中加入足量C与NO发生反应,所得数据如表,回答下列问题。
实验编号 | 温度/℃ | 起始时NO的物质的量/mol | 平衡时N2的物质的量/mol |
1 | 700 | 0.40 | 0.09 |
2 | 800 | 0.24 | 0.08 |
①结合表中数据,判断该反应的△H____0(填“>”或“<”),理由是_________。
②判断该反应达到平衡的依据是_______。
A.容器内气体密度恒定 B.容器内各气体浓度恒定
C.容器内压强恒定 D.2v正(NO)= v逆(N2)
(3)700℃时,若向2L体积恒定的密闭容器中充入一定量N2和CO2发生反应:N2(g)+CO2(g)![]() C(s)+2NO(g) ;其中N2、NO物质的量随时间变化的曲线如下图所示。请回答下列问题。
C(s)+2NO(g) ;其中N2、NO物质的量随时间变化的曲线如下图所示。请回答下列问题。
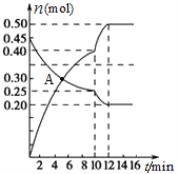
①0~10 min内的CO2平均反应速率v=____________。
②图中A点v(正)___v(逆)(填“>”、“<”或“=”)。
③第10 min时,外界改变的条件可能是_____________。
A.加催化剂 B.增大C的物质的量
C.减小CO2的物质的量 D.升温 E.降温
【题目】滴定法是解决化学分析问题的常用方法。滴定的方法有酸碱中和滴定、氧化还原滴定、沉淀滴定、络合滴定等。
I.如图为某浓度的NaOH溶液滴定10.00mL一定浓度的盐酸的示意图。根据图像

(1)HCl溶液的浓度是__________;NaOH溶液的浓度是_______;
(2)x=________。
(3)若向20mL稀氨水中逐滴加入等浓度的盐酸,则下列变化趋势正确的是________(填字母)。


ΙΙ.氧化还原滴定实验与中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。
(4)人体血液里Ca2+的浓度一般采用mg/cm3来表示。抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度,抽取血样20.00mL,经过上述处理后得到草酸,再用0.020mol/L KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00mL KMnO4溶液。
滴定的实验数据如下所示:
实验编号 | 待测血液的体积/mL | 滴入KMnO4溶液的体积/mL |
1 | 20.00 | 11.95 |
2 | 20.00 | 13.00 |
3 | 20.00 | 12.05 |
①滴定时,盛放高锰酸钾溶液的仪器名称为_________确定反应达到终点的现象_____________。
②草酸跟酸性KMnO4溶液反应的离子方程式为:2MnO42-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O,根据所给数据计算血液样品中Ca2+离子的浓度为__________mg/cm3