题目内容
5.从一种生产醋酸乙烯酯的废触媒(含醋酸锌、活性炭及少量有机物及氧化亚铁)中制取氯化锌中实验步骤如图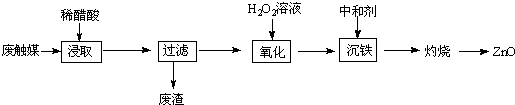
(1)浸取在三口烧瓶中进行,需给三口烧瓶加热并搅拌的目的是提高浸出速率和浸取率;浸出率随着浸取时间先增大后又减小,其原因是开始反应是加热搅拌加快浸出速率,但生成的醋酸锌被活性炭吸附,浸出率减小.
(2)若先将废触媒在马弗炉中通氧气500℃处理一段时间,浸出率会大大提高,其原因是将吸附在活性炭孔内的醋酸锌全部释放出来.
(3)加入H2O2发生反应的离子方程式为H2O2+2Fe2++2H+=2Fe3++2H2O;沉铁需将溶液pH调整到约为5,最适宜的中和剂是bc(选填序号:a.石灰水 b.ZnO c.Zn.).
(4)高温灼烧时用到的硅酸盐质的仪器有酒精灯、坩埚和泥三角.
(5)某探究学习小组的同学拟利用废电池锌皮(主要成分为Zn,还含有少量的铁)制取氧化锌.如表列出了几种离子生成氢氧化物沉淀的pH:
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |
分析 废触媒加入稀醋酸浸取过滤得到的溶液中加入过氧化氢氧化亚铁离子为铁离子,加入试剂调节溶液的PH使铁离子全部沉淀,过滤得到滤液再加入试剂调节溶液PH使锌离子全部沉淀生成氢氧化锌沉淀,过滤得到沉淀灼烧得到氧化锌,
(1)浸取在三口烧瓶中进行,需给三口烧瓶加热并搅拌的目的是提高浸出速率和浸取率;
(2)将废触媒在马弗炉中通氧气500℃处理一段时间,使活性炭与氧气反应,将吸附在活性炭孔内的醋酸锌全部释放出来;
(3)过氧化氢具有氧化性,能氧化亚铁离子为铁离子,便于调节溶液PH沉淀铁离子分离,调节溶液PH的试剂能和酸反应且不能引入新的杂质离子;
(4)高温灼烧时用到的硅酸盐质的仪器为酒精灯、坩埚、泥三角等;
(5)滴加2.0mol•L-1 HNO3,使Fe2+转化完全为Fe3+,滴加1.0mol•L-1 NaOH溶液,形成氢氧化铁沉淀,除杂后形成氢氧化锌沉淀,过滤、洗涤、干燥900℃煅烧制得氧化锌.
解答 解:(1)浸取在三口烧瓶中进行,需给三口烧瓶加热并搅拌的目的是提高浸出速率和浸取率,浸出率随着浸取时间先增大后又减小,其原因是;开始反应是加热搅拌加快浸出速率,但生成的醋酸锌被活性炭吸附,浸出率减小
故答案为:开始反应是加热搅拌加快浸出速率,但生成的醋酸锌被活性炭吸附,浸出率减小;
(2)将废触媒在马弗炉中通氧气500℃处理一段时间,使活性炭与氧气反应,将吸附在活性炭孔内的醋酸锌全部释放出来,浸出率会大大提高,
故答案为:将吸附在活性炭孔内的醋酸锌全部释放出来;
(3)过氧化氢具有氧化性,能氧化亚铁离子为铁离子,反应的离子方程式为:H2O2+2Fe2++2H+=2Fe3++2H2O,便于调节溶液PH沉淀铁离子分离,调节溶液PH的试剂能和酸反应且不能引入新的杂质离子,CaO会引入钙离子,不选,Zn、ZnO会和酸反应能调节溶液的PH,使铁离子全部沉淀,
故答案为:H2O2+2Fe2++2H+=2Fe3++2H2O,bc;
(4)高温灼烧时用到的硅酸盐质的仪器为酒精灯、坩埚、泥三角等,
故答案为:坩埚、泥三角;
(5)滴加2.0mol•L-1 HNO3,使Fe2+转化完全为Fe3+,滴加1.0mol•L-1 NaOH溶液,调节溶液PH约为5(或3.2≤pH<5.9),使Fe3+沉淀完全,向滤液中滴加1.0mol•L-1NaOH,调节溶液PH约为10(或8.9≤pH≤11),使Zn2+沉淀完全,900℃煅烧,制得氧化锌,
故答案为:向滤液中加入2.0mol•L-1 HNO3,使Fe2+转化完全为Fe3+,使其充分反应;滴加1.0mol•L-1NaOH,调节溶液PH约为5(或3.2≤pH<5.9),使Fe3+沉淀完全;向滤液中滴加1.0mol•L-1NaOH,调节溶液PH约为10(或8.9≤pH≤11),使Zn2+沉淀完全.
点评 本题考查了物质分离提纯的方法和流程分析应用,为高频考点,侧重于学生的分析能力和实验能力的考查,解答该类题目,注意把握实验原理和操作流程的目的,主要是物质性质的理解,题目难度中等.

 一课一练课时达标系列答案
一课一练课时达标系列答案①向烧杯中加入2mL2mol•L-1的盐酸 ②向烧杯中加入少量炭粉 ③加入少量CuCl2晶体 ④加热.
| A. | ①② | B. | ③④ | C. | ①②④ | D. | ②③④ |
(1)CO可用于炼铁,已知:Fe2O3(s)+3C(s)═2Fe (s)+3CO(g)△H1=+489.0kJ•mol-1,
C(s)+CO2(g)═2CO(g)△H2=+172.5kJ•mol-1,则CO还原Fe2O3(s)的热化学方程式为Fe2O3 (s)+3CO(g)=2Fe(s)+3CO2 (g)△H=-28.5kJ•mol-1.
(2)CO与O2设计成燃料电池(以KOH溶液为电解液).该电池的负极反应式为CO+4OH--2e-=CO32-+2H2O.
(3)CO2和H2充入一定体积的恒容密闭容器中,在两种温度下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g) 测得CH3OH的物质的量随时间的变化如图1.
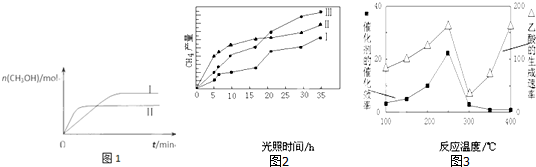
①该反应的△H>0(填“大于或小于”),曲线I、Ⅱ对应的平衡常数大小关系为KⅠ<KⅡ(填“>、=或<”).
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡.
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1mol CO2、3mol H2 | a molCO2、3a molH2、 b molCH3OH(g)、b molH2O(g) |
(4)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2.紫外光照射时,在不同催化剂(I、II、III)作用下,CH4产量随光照时间的变化如图2.在0~15小时内,CH4的平均生成速率I、II和III从小到大的顺序为II>III>I(填序号).
(5)以TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸.在不同温度下催化剂的催化效率与乙酸的生成速率的关系如图3.
①当温度在300℃~400℃范围时,温度是乙酸生成速率的主要影响因素.
②Cu2Al2O4可溶于稀硝酸,稀硝酸还原产物为NO,写出有关的离子方程式3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO↑+16H2O.
| A. | 2 0 1 2 0 2 | B. | 0 2 1 0 1 2 | ||
| C. | 2 4 3 2 2 6 | D. | 2 10 6 2 5 12 |
| A. | Na、K合金熔点低、沸点高,可用作原子反应堆导热液 | |
| B. | SiO2具有高沸点,可用作制备光导纤维 | |
| C. | NH3具有还原性,可用作制冷剂 | |
| D. | HF是强酸,可用于雕刻玻璃 |

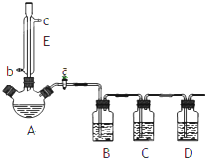 某兴趣小组同学设计了如下装置(其中夹持仪器、加热仪器及冷却水管没有画出),用加热苯甲酸、浓H2SO4和乙醇混合物的方法来制备苯甲酸乙酯,并检验反应的部分副产物.且苯甲酸乙酯的沸点为213℃,乙醚的沸点为34.6℃.
某兴趣小组同学设计了如下装置(其中夹持仪器、加热仪器及冷却水管没有画出),用加热苯甲酸、浓H2SO4和乙醇混合物的方法来制备苯甲酸乙酯,并检验反应的部分副产物.且苯甲酸乙酯的沸点为213℃,乙醚的沸点为34.6℃. .
.