题目内容
16.相同浓度的一元强酸X溶液和一元弱酸Y溶液各10mL分别与足量金属镁反应.下列叙述正确的是( )| A. | 反应起始时速率:X=Y | B. | 反应消耗镁的量:X<Y | ||
| C. | 产生H2量:X>Y | D. | 反应片刻后速率:X>Y |
分析 相同浓度的一元强酸X溶液和一元弱酸Y溶液各10mL,所含酸的物质的量相同,足量金属镁反应产生氢气的物质的量相同,氢离子浓度不同,开始时反应速率X比Y快,反应放热多,溶液温度高,反应速率加快,据此分析.
解答 解:A、相同浓度的一元强酸X溶液和一元弱酸Y溶液,X溶液中氢离子浓度比Y大,反应速率快,故A错误;
B、足量金属镁反应产生氢气的物质的量相同,消耗Mg的量相同,给B错误;
C、足量金属镁反应产生氢气的物质的量相同,故C错误;
D、氢离子浓度不同,开始时反应速率X比Y快,X反应放热多,溶液温度高,反应速率加快,故D正确;
故选D.
点评 本题考查了影响反应速率的因素,注意相同浓度相同体积的一元强酸和弱酸与足量金属反应,生成氢气的量相同,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
6.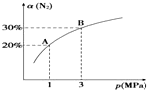 某温度下,对于反应N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1.N2的平衡转化率(α)与体系总压强(p)的关系如图所示.下列说法正确的是( )
某温度下,对于反应N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1.N2的平衡转化率(α)与体系总压强(p)的关系如图所示.下列说法正确的是( )
 某温度下,对于反应N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1.N2的平衡转化率(α)与体系总压强(p)的关系如图所示.下列说法正确的是( )
某温度下,对于反应N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1.N2的平衡转化率(α)与体系总压强(p)的关系如图所示.下列说法正确的是( )| A. | 将1 mol氮气、3 mol氢气,置于1 L密闭容器中发生反应,放出的热量为92.4 kJ | |
| B. | 平衡状态由A变到B时,平衡常数K(A)<K(B) | |
| C. | 上述反应在达到平衡后,增大压强,H2的转化率增大 | |
| D. | 升高温度,平衡向逆反应方向移动,说明逆反应速率增大,正反应速率减小 |
4.短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13.X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者Y原子最外层电子数的3倍.下列说法不正确的( )
| A. | X与Y形成的化合物是离子化合物,且最外层电子均满足8电子结构的 | |
| B. | 工业上通常采用电解Y的熔融氧化物的方法制得Y | |
| C. | 其离子半径大小:Z>Y>X | |
| D. | X和Z的最高价氧化物对应的水化物都是强酸 |
11.如表所示的五种元素中,甲、乙、丙、丁为短周期元素,其中乙是地壳中含量最多的元素.下列说法正确的是
( )
( )
| 甲 | 乙 | ||
| 丙 | 丁 | ||
| 戊 |
| A. | 原子半径:甲>乙 | |
| B. | 丁和戊的原子核外电子数相差8 | |
| C. | 最高价氧化物对应的水化物的酸性:丙>丁 | |
| D. | 甲的单质在空气中燃烧生成只含共价键的化合物 |
1.某溶液中可能含有Na+、NH4+、Ba2+、Br-、CO32-、I-、SO32-.某兴趣小组为确定该溶液的组成,进行了下列实验:取样,滴加足量氯水,有气泡产生,溶液呈橙色;向橙色溶液中加BaCl2溶液或淀粉均无明显变化.下列说法正确的是( )
| A. | 溶液中一定存在Na+、I-、CO32- | |
| B. | 溶液中一定不存在的只有I-、SO32- | |
| C. | 只需再进行一个实验,就可完全确定溶液的组成 | |
| D. | 溶液中一定存在Br-、CO32-,至少存在Na+、NH4+中的一种 |
3.黑色金属材料是工业上对铁、铬和锰的统称,这三种金属都是冶炼钢铁的主要原料,回答下列问题.
(1)基态铬原子有6个未成对电子;一价锰离子的核外电子排布式为1s22s22p63s23p63d54s1;晶体盐是一种配合物,化学式为Kx[Fe(CN)]Y•3H2O,该配合物中配体的化学式为CN-,与该配体互为等电子的分子有N2(举一例).
(2)酸性KMnO4能将甲苯氧化为苯甲酸,甲苯中碳原子的杂化轨道类型为sp3;甲酸苯酚酯是苯甲酸的同分异构体,但沸点比苯甲酸低得多,其原因是苯甲酸分子间存在氢键,熔点、沸点增大;
高锰酸的结构式为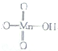 它属于强(填“强”或“弱”)酸.
它属于强(填“强”或“弱”)酸.
(3)Fe3+是H2O分解的催化剂,已知下列键能数据;
①1molH2O中含α键的数目为2mol.
②2H2O2(l)=2H2O(l)+O2(g),该分解反应为放(填“放”或“吸”)热反应.
(4)每个金属铬晶胞中有2个Cr原子,则晶胞中Cr原子的配位数为8;其晶胞边长为αcm,则铬单质约密度为$\frac{104}{{a}^{3}N{\;}_{A}}$g•cm-3(不必计算出结果).
(1)基态铬原子有6个未成对电子;一价锰离子的核外电子排布式为1s22s22p63s23p63d54s1;晶体盐是一种配合物,化学式为Kx[Fe(CN)]Y•3H2O,该配合物中配体的化学式为CN-,与该配体互为等电子的分子有N2(举一例).
(2)酸性KMnO4能将甲苯氧化为苯甲酸,甲苯中碳原子的杂化轨道类型为sp3;甲酸苯酚酯是苯甲酸的同分异构体,但沸点比苯甲酸低得多,其原因是苯甲酸分子间存在氢键,熔点、沸点增大;
高锰酸的结构式为
 它属于强(填“强”或“弱”)酸.
它属于强(填“强”或“弱”)酸.(3)Fe3+是H2O分解的催化剂,已知下列键能数据;
| 化学键 | H-O | O-O | O-O |
| 键能/(J.mol-1) | 163 | 142 | 438 |
②2H2O2(l)=2H2O(l)+O2(g),该分解反应为放(填“放”或“吸”)热反应.
(4)每个金属铬晶胞中有2个Cr原子,则晶胞中Cr原子的配位数为8;其晶胞边长为αcm,则铬单质约密度为$\frac{104}{{a}^{3}N{\;}_{A}}$g•cm-3(不必计算出结果).
