题目内容
11.某校化学学习小组,在学习了铜和浓硫酸的反应后,探究足量的锌与浓硫酸反应的现象,并完成某些性质实验.设计了如图所示的装置.试回答: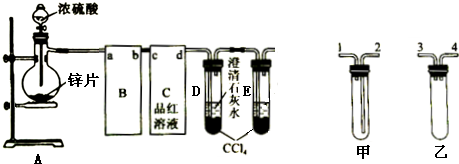
(1)A装置中,盛装锌片的仪器名称是蒸馏烧瓶.
(2)请从甲、乙中选择合适的装置填入B、C中,并进行正确连接.a接3(或4),c接2(用序号表示).
(3)D、E两支试管中CCl4的作用是防止倒吸.
(4)本实验能证明浓硫酸具有强氧化性的实验现象为C中品红溶液褪色.
(5)D中出现浑浊现象,其离子方程式为Ca2++2OH-+SO2=CaSO3↓+H2O.
(6)某学生注意观察到:实验开始后,C、D、E中均有气泡产生;随后气泡量减少,品红溶液褪色,D中出现浑浊;反应一段时间后,C、D、E中的气泡量又会明显增加.请用化学方程式表示“反应一段时间后气泡量又会明显增加”的原因Zn+H2SO4=ZnSO4+H2↑.
(7)E是尾气处理装置,应盛放的试剂为氢氧化钠溶液.
分析 (1)根据仪器的构造写出其名称;
(2)B装置为安全瓶,防止倒吸,应该装置甲;C用品红溶液具有二氧化硫,导管应该长进短出;
(2)二氧化硫易溶于水,难溶于四氯化碳,二氧化硫通过四氯化碳,可防止倒吸;
(3)浓硫酸中硫为+6价,具有强氧化性,被锌还原为+4价的硫,则品红溶液褪色可以证明浓硫酸具有强氧化性;
(4)二氧化硫与氢氧化钙反应生成亚硫酸钙沉淀;
(5)锌与稀硫酸反应生成硫酸锌和氢气;
(6)锌和浓硫酸反应生成硫酸锌和二氧化硫和水,当硫酸浓度变稀时,锌与稀硫酸反应生成硫酸锌和氢气,用无水硫酸铜检验水的存在,品红检验二氧化硫的存在,氧化铜检验氢气的存在;
(7)二氧化硫能够与氢氧化钠溶液反应,通常用氢氧化钠溶液吸收二氧化硫.
解答 解:(1)根据图示可知,A装置中,盛装锌片的仪器名称为蒸馏烧瓶,故答案为:蒸馏烧瓶;
(2)通常状况下,1体积水中可溶解40体积的二氧化硫气体,装置乙可防止二氧化硫与品红作用时被吸入锌与硫酸反应的容器中;二氧化硫与品红溶液作用,需长管进,所以导管连接顺序为:a接4(或3)→b→c→2,
故答案为:3(或4);2;
(3)二氧化硫易溶于水,难溶于四氯化碳,二氧化硫通过四氯化碳,然后再与澄清的石灰水反应,起缓冲作用,可防止倒吸,
故答案为:防止倒吸;
(4)二氧化硫可使品红溶液褪色,则C中品红溶液褪色可检验二氧化硫的存在,从而证明浓硫酸具有强氧化性,
故答案为:C中品红溶液褪色;
(5)二氧化硫和澄清的石灰水反应生成亚硫酸钙和水,亚硫酸钙为难溶于水的沉淀,离子反应为Ca2++2OH-+SO2═CaSO3↓+H2O,
故答案为:Ca2++2OH-+SO2═CaSO3↓+H2O;
(6)锌为较活泼的金属,在金属活动顺序表中排在氢的前面,所以锌和稀硫酸反应生成硫酸锌和氢气,反应为Zn+H2SO4(稀)═ZnSO4+H2↑,故答案为:Zn+H2SO4(稀)═ZnSO4+H2↑;
(7)二氧化硫有毒,且能够与氢氧化钠溶液反应,多余的二氧化硫可用氢氧化钠溶液吸收,防止污染空气,
故答案为:氢氧化钠溶液.
点评 本题考查浓硫酸的性质,题目难度中等,明确浓硫酸、稀硫酸分别与锌反应的原理为解答关键,注意熟练掌握二氧化硫的性质及检验方法,试题知识点较多,考查较全面,有利于培养学生的分析能力及化学实验能力.

 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案| A. | X与Y形成的化合物是离子化合物,且最外层电子均满足8电子结构的 | |
| B. | 工业上通常采用电解Y的熔融氧化物的方法制得Y | |
| C. | 其离子半径大小:Z>Y>X | |
| D. | X和Z的最高价氧化物对应的水化物都是强酸 |
 汽车尾气中的主要污染物是NO和CO.为了减轻大气污染,人们提出通过以下反应来处理汽车尾气:
汽车尾气中的主要污染物是NO和CO.为了减轻大气污染,人们提出通过以下反应来处理汽车尾气:(1)2NO(g)+2CO(g)≒2CO2(g)+N2(g)△H=-746.5KJ/mol (条件为使用催化剂)
已知:
2C (s)+O2(g)≒2CO(g)△H=-221.0KJ/mol
C (s)+O2(g)≒CO2(g)△H=-393.5KJ/mol
则N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-1.
(2)T℃下,在一容积不变的密闭容器中,通入一定量的NO和CO,用气体传感器测得不同时间NO和CO的浓度如下表
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| C(NO)10-4 mol/L | 10.0 | 4.50 | C1 | 1.50 | 1.00 | 1.00 |
| C(CO)10-3 mol/L | 3.60 | 3.05 | C2 | 2.75 | 2.70 | 2.70 |
A.4.20 B.4.00 C.3.50 D.2.50
②根据①中数据计算前2s内的平均反应速率v(CO2)=3.75×10-4 mol/(L.s).
③不能作为判断该反应达到平衡状态的标志是ab.(填字母标号)
a.2v正(CO)=v逆(N2)
b.容器中混合气体的密度保持不变
c.容器中气体的压强不变
d.CO2的体积分数不变
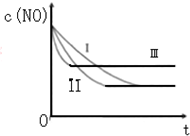
(3)研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率.根据下表设计的实验测得混合气体中NO的浓度随时间t变化的趋势如如图所示:
| 实验 编号 | T/°C | NO初始浓 度/10-3mol•L-1 | CO初始浓 度/10-3mol•L-1 | 催化剂的比 表面积/m2•g-1 |
| ① | 350 | 1.20 | 5.80 | 124 |
| ② | 280 | 1.20 | 5.80 | 124 |
| ③ | 280 | 1.20 | 5.80 | 82 |
(4)已知:CO通入新制的银氨溶液中可生成银镜,同时释放一种能使湿润的红色石蕊试纸变蓝的气体.某温度下,向1L密闭容器中充入1molNO和1molCO,反应达到平衡后,将平衡混合气体通入足量新制的银氨溶液中,生成43.2g Ag,则该温度下,反应2NO(g)+2CO(g)≒2CO2(g)+N2(g)(条件为使用催化剂)的化学平衡常数K=160.
(5)CO可作燃料电池的燃气.用Li2CO3和Na2CO3的熔融盐混合物做电解质,空气与CO2的混合气为正极助燃气,制得650°C下工作的燃料电池.该电池总反应方程式为2CO+O2=2CO2 则负极反应式为2CO+2CO32--4e-═4CO2.
(1)基态铬原子有6个未成对电子;一价锰离子的核外电子排布式为1s22s22p63s23p63d54s1;晶体盐是一种配合物,化学式为Kx[Fe(CN)]Y•3H2O,该配合物中配体的化学式为CN-,与该配体互为等电子的分子有N2(举一例).
(2)酸性KMnO4能将甲苯氧化为苯甲酸,甲苯中碳原子的杂化轨道类型为sp3;甲酸苯酚酯是苯甲酸的同分异构体,但沸点比苯甲酸低得多,其原因是苯甲酸分子间存在氢键,熔点、沸点增大;
高锰酸的结构式为
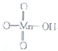 它属于强(填“强”或“弱”)酸.
它属于强(填“强”或“弱”)酸.(3)Fe3+是H2O分解的催化剂,已知下列键能数据;
| 化学键 | H-O | O-O | O-O |
| 键能/(J.mol-1) | 163 | 142 | 438 |
②2H2O2(l)=2H2O(l)+O2(g),该分解反应为放(填“放”或“吸”)热反应.
(4)每个金属铬晶胞中有2个Cr原子,则晶胞中Cr原子的配位数为8;其晶胞边长为αcm,则铬单质约密度为$\frac{104}{{a}^{3}N{\;}_{A}}$g•cm-3(不必计算出结果).
| A. | 多植树造林,严禁乱砍滥伐 | B. | 使用新能源,减少煤炭使用 | ||
| C. | 少开私家车,控制尾气排放 | D. | 杜绝浪费,实施“光盘行动” |
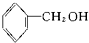 酚类-OH②
酚类-OH② 醇类-OH③
醇类-OH③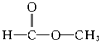 酯类
酯类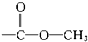
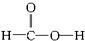 醚类
醚类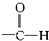
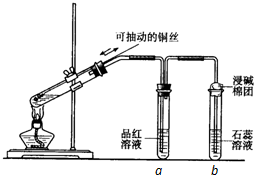 某同学设计实验证明铜与浓硫酸能发生反应,并检验生成气体的性质,如图所示,在试管里加入2mL浓硫酸,用带导管和一个小孔的胶管塞紧,从孔中插入一根铜丝,加热,把放出的气体依次通入品红溶液和石蕊溶液中.
某同学设计实验证明铜与浓硫酸能发生反应,并检验生成气体的性质,如图所示,在试管里加入2mL浓硫酸,用带导管和一个小孔的胶管塞紧,从孔中插入一根铜丝,加热,把放出的气体依次通入品红溶液和石蕊溶液中.