题目内容
14.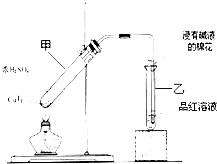 某教师在课堂上用右图所示的装置来验证浓硫酸与铜是否发生反应,并探讨反应所产生气体的性质.请回答下列问题:
某教师在课堂上用右图所示的装置来验证浓硫酸与铜是否发生反应,并探讨反应所产生气体的性质.请回答下列问题:(1)试管乙中发生的现象是品红溶液褪色,
该现象能说明产生的气体具有漂白性.
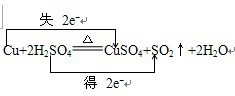
(2)写出试管甲中所发生反应的化学方程式,并标明电子转移方向和数目.
 .
.(3)试管乙口部浸有碱液的棉花的作用是吸收SO2.
(4)SO2的排放是造成酸雨的主要因素,某同学通过实验探究,得出酸雨pH随时间的增加而减小的结论.为进一步研究酸雨的成分,该同学取某一时段的这种雨水V L,加入0.5mol/L的Ba(OH)2溶液至不再产生沉淀时,恰好消耗20.00mL Ba(OH)2溶液.请计算:
①该雨水中共溶解标准状况下SO2的体积多少mL?
②若生成沉淀物的质量为2.25g,求出沉淀物的组成.(请写出计算过程)
分析 (1)金属铜和浓硫酸发生反应生成硫酸铜、水和二氧化硫,二氧化硫能使品红褪色,具有漂白性;
(2)金属铜和浓硫酸发生反应生成硫酸铜、水和二氧化硫,根据化合价的升高值=化合价的降低值=转移电子数来标电子转移情况;
(3)二氧化硫有毒,属于酸性氧化物,能和碱反应;
(4)①写出反应的化学方程式,根据氢氧化钡的物质的量计算出二氧化硫的物质的量,再计算出标况下二氧化硫的体积;
②利用极值法讨论沉淀的组成成分.
解答 解:(1)金属铜和浓硫酸发生反应生成硫酸铜、水和二氧化硫,生成的二氧化硫能使品红褪色,说明二氧化硫具有漂白性,
故答案为:品红溶液褪色;漂白;
(2)金属铜和浓硫酸发生反应生成硫酸铜、水和二氧化硫:Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O,化合价的升高值=化合价的降低值=转移电子数=2,用单线桥表示电子转移情况如下: ,故答案为:
,故答案为: ;
;
(3)二氧化硫有毒,属于酸性氧化物,能和碱反应生成盐和水,在装置口处浸有碱液的棉花可以和二氧化硫反应,
故答案为:吸收SO2;
(4)①二氧化硫和氢氧化钡的反应方程式为:SO2+Ba(OH)2=BaSO3↓+H2O,
20.00mL 0.5mol/L的 Ba(OH)2溶液中含有氢氧化钡的物质的量为:0.5mol/L×0.02L=0.01mol,根据反应可知,空气中含有二氧化硫的物质的量与氢氧化钡的物质的量相等,都是0.01mol,标况下0.01mol二氧化硫的体积为:22.4L/mol×0.01mol=0.0224L=22.4mL,
答:该雨水中共溶解标准状况下SO2的体积为22.4mL;
②0.5mol/L 20.00mL 的Ba(OH)2溶液和二氧化硫反应,如果全部转化为亚硫酸钡,根据钡原子守恒,则生成亚硫酸钡的质量为:0.01mol×217g/mol=2.17,如果全部转化为硫酸钡,根据钡原子守恒,则生成硫酸钡的质量为:0.01mol×233g/mol=2.33g,2.17g<2.250g<2.33g,
所以沉淀物的组成为BaSO3和BaSO4,
答:生成的沉淀为BaSO3和BaSO4的混合物.
点评 本题考查了浓硫酸的性质、化学方程式的计算、氧化还原反应的应用等知识,题目难度中等,注意掌握氧化还原反应的实质、浓硫酸的性质,明确极值法在化学计算中的应用方法.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 水由液态变为玻璃态,体积缩小 | |
| B. | 水由液态变为玻璃态,体积膨胀 | |
| C. | 玻璃态是水的一种特殊状态晶体 | |
| D. | 玻璃态水是水分子在空间有规则排列形成的 |
 汽车尾气中的主要污染物是NO和CO.为了减轻大气污染,人们提出通过以下反应来处理汽车尾气:
汽车尾气中的主要污染物是NO和CO.为了减轻大气污染,人们提出通过以下反应来处理汽车尾气:(1)2NO(g)+2CO(g)≒2CO2(g)+N2(g)△H=-746.5KJ/mol (条件为使用催化剂)
已知:
2C (s)+O2(g)≒2CO(g)△H=-221.0KJ/mol
C (s)+O2(g)≒CO2(g)△H=-393.5KJ/mol
则N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-1.
(2)T℃下,在一容积不变的密闭容器中,通入一定量的NO和CO,用气体传感器测得不同时间NO和CO的浓度如下表
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| C(NO)10-4 mol/L | 10.0 | 4.50 | C1 | 1.50 | 1.00 | 1.00 |
| C(CO)10-3 mol/L | 3.60 | 3.05 | C2 | 2.75 | 2.70 | 2.70 |
A.4.20 B.4.00 C.3.50 D.2.50
②根据①中数据计算前2s内的平均反应速率v(CO2)=3.75×10-4 mol/(L.s).
③不能作为判断该反应达到平衡状态的标志是ab.(填字母标号)
a.2v正(CO)=v逆(N2)
b.容器中混合气体的密度保持不变
c.容器中气体的压强不变
d.CO2的体积分数不变
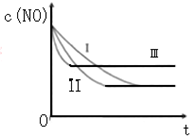
(3)研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率.根据下表设计的实验测得混合气体中NO的浓度随时间t变化的趋势如如图所示:
| 实验 编号 | T/°C | NO初始浓 度/10-3mol•L-1 | CO初始浓 度/10-3mol•L-1 | 催化剂的比 表面积/m2•g-1 |
| ① | 350 | 1.20 | 5.80 | 124 |
| ② | 280 | 1.20 | 5.80 | 124 |
| ③ | 280 | 1.20 | 5.80 | 82 |
(4)已知:CO通入新制的银氨溶液中可生成银镜,同时释放一种能使湿润的红色石蕊试纸变蓝的气体.某温度下,向1L密闭容器中充入1molNO和1molCO,反应达到平衡后,将平衡混合气体通入足量新制的银氨溶液中,生成43.2g Ag,则该温度下,反应2NO(g)+2CO(g)≒2CO2(g)+N2(g)(条件为使用催化剂)的化学平衡常数K=160.
(5)CO可作燃料电池的燃气.用Li2CO3和Na2CO3的熔融盐混合物做电解质,空气与CO2的混合气为正极助燃气,制得650°C下工作的燃料电池.该电池总反应方程式为2CO+O2=2CO2 则负极反应式为2CO+2CO32--4e-═4CO2.
(1)基态铬原子有6个未成对电子;一价锰离子的核外电子排布式为1s22s22p63s23p63d54s1;晶体盐是一种配合物,化学式为Kx[Fe(CN)]Y•3H2O,该配合物中配体的化学式为CN-,与该配体互为等电子的分子有N2(举一例).
(2)酸性KMnO4能将甲苯氧化为苯甲酸,甲苯中碳原子的杂化轨道类型为sp3;甲酸苯酚酯是苯甲酸的同分异构体,但沸点比苯甲酸低得多,其原因是苯甲酸分子间存在氢键,熔点、沸点增大;
高锰酸的结构式为
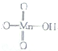 它属于强(填“强”或“弱”)酸.
它属于强(填“强”或“弱”)酸.(3)Fe3+是H2O分解的催化剂,已知下列键能数据;
| 化学键 | H-O | O-O | O-O |
| 键能/(J.mol-1) | 163 | 142 | 438 |
②2H2O2(l)=2H2O(l)+O2(g),该分解反应为放(填“放”或“吸”)热反应.
(4)每个金属铬晶胞中有2个Cr原子,则晶胞中Cr原子的配位数为8;其晶胞边长为αcm,则铬单质约密度为$\frac{104}{{a}^{3}N{\;}_{A}}$g•cm-3(不必计算出结果).
| A. | 11与17 | B. | 11与10 | C. | 1与17 | D. | 11与8 |
