题目内容
15.2012年4月,中央电视台曝光了不法商贩将重金属铬(Cr)超标的工业明胶加工成药用胶囊的“毒胶囊”事件.已知铬的原子序数为24,下列叙述正确的是( )| A. | 铬位于元素周期表的第四周期第Ⅷ族 | |
| B. | 警察通过装有橙色的酸性重铬酸钾的装置检查司机是否酒后驾车 | |
| C. | 已知铬元素的一种同位素的质量数为53,则该同位素有53个中子 | |
| D. | 中子数为29的铬原子符号表示为${\;}_{24}^{29}$Cr |
分析 铬的原子序数为24,位于周期表第4周期ⅥB族,一种同位素的质量数为53,则中子数为53-24=29,铬原子符号表示为${\;}_{24}^{53}$Cr,以此解答该题.
解答 解:A.Cr位于周期表第4周期ⅥB族,故A错误;
B.橙色的酸性重铬酸钾具有强氧化性,与乙醇发生氧化还原反应,橙色变为黄色,以此可检查司机是否酒后驾车,故B正确;
C.铬元素的一种同位素的质量数为53,所以中子数为53-24=29,故C错误;
D.中子数为53-24=29,铬原子符号表示为${\;}_{24}^{53}$Cr,故D错误;
故选B.
点评 本题考查较综合,涉及元素周期表的结构及应用、原子的构成及氧化还原反应等,为高频考点,把握原子序数确定元素的位置、性质为解答的关键,注重基础知识的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.下列说法错误的是( )
| A. | 红葡萄酒密封窖藏,储存一段时间,香味愈浓,原因之一是储存过程中生成了有香味的酯 | |
| B. | 用浸泡过高锰酸钾溶液的硅土吸收水果或花朵产生的乙烯,可以延迟长水果或花朵的成熟期 | |
| C. | 炒菜时,加一点酒和醋能使菜更加味香可口,原因是有酯类生成 | |
| D. | 油脂能增加食物的滋味,增进食欲,因此在饮食中没有必要控制油脂的摄入量 |
6.下列物质不属于高分子化合物的是( )
| A. | 纤维素 | B. | 蛋白质 | C. | 淀粉 | D. | 蔗糖 |
3.锌片和铜片用导线连接后插入稀硫酸中可构成原电池,从原电池角度判断锌片作( )
| A. | 正极 | B. | 负极 | C. | 阴极 | D. | 阳极 |
10.以下实验事实可以证明一水合氨是弱电解质的是( )
①0.1mol/L的氨水可以使酚酞溶液变红 ②0.1mol/L的氯化铵溶液的pH约为5 ③0.1mol/L的氨水的pH值为11.2 ④铵盐受热易分解.
①0.1mol/L的氨水可以使酚酞溶液变红 ②0.1mol/L的氯化铵溶液的pH约为5 ③0.1mol/L的氨水的pH值为11.2 ④铵盐受热易分解.
| A. | ①② | B. | ②③ | C. | ③④ | D. | ②④ |
20.下列状态下,不能导电的强电解质是( )
| A. | 冰醋酸 | B. | 纯硫酸 | C. | 蔗糖溶液 | D. | 氢氧化钠溶液 |
5.常温下能用铁制或铝制容器盛放的是( )
| A. | 稀硝酸、稀硫酸 | B. | 硝酸银溶液 | C. | 浓硝酸、浓硫酸 | D. | 硫酸铜溶液 |
 ;
;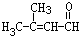 .
.