题目内容
【题目】汽车作为一种现代交通工具正在进入千家万户,汽车尾气中含有CO、NOx等有毒气体,其污染问题也成为当今社会急需解决的问题。
(1)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如图:

则该反应的热化学方程式为_____________________________。
(2)对汽车加装尾气净化装置,可使CO、NOx有毒气体相互反应转化为无毒气体。
2xCO+2NOx ="=" 2xCO2+N2,当转移电子物质的量为0.4x mol时,该反应生成标准状况下的N2体积_____________________L。
(3)一氧化碳是一种用途相当广泛的化工基础原料。可以还原金属氧化物,还可以用来合成很多有机物如甲醇等。在压强为0.1 MPa条件下,将a mol CO与3a mol H2的混合气体在催化剂作用下反应生成甲醇: CO(g)+2H2(g)![]() CH3OH(g);△H= -b kJmol-1
CH3OH(g);△H= -b kJmol-1
①该反应的平衡常数表达式为_____________________________。
②若容器容积不变,下列措施可增加甲醇产率的是______________
A.升高温度 | B.将CH3OH(g)从体系中分离 |
C.充入He,使体系总压强增大 | D.再充入1 mol CO和3 mol H2 |
③经测定不同温度下该反应的平衡常数如下:
温度(℃) | 250 | 300 | 350 |
K | 2.041 | 0.270 | 0.012 |
若某时刻、250℃测得该反应的反应物与生成物的浓度为c(CO) =0.4 mol/L、c(H2)=0.4 mol/L、c(CH3OH)=0.8 mol·L-1, 则此时v正___________v逆(填>、<或=)。
(4)甲醇是重要的基础化工原料,又是一种新型的燃料,最近有人制造了一种燃料电池,一个电极通入空气,另一个电极加入甲醇,电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-离子。该电池的正极反应式为_____________________________。电池工作时,固体电解质里的O2-向_______极移动。
【答案】N2(g)+O2(g)=2NO(g);△H=+183 kJ/moL 2.24L K=![]() BD < O2+4e-=2O2- 负
BD < O2+4e-=2O2- 负
【解析】
(1)根据反应热=反应物的总键能-生成物的总键能;
(2)依据化学方程式中元素化合价变化计算电子转移总数,每生成1molN2电子转移4xmol电子计算;
(3)①依据化学方程式和平衡常数概念书写平衡常数表达式;
②增加甲醇产率需要平衡正向进行,依据平衡移动原理结合反应特征是气体体积减小的放热反应分析选项判断;
③依据计算的浓度商和该温度下的平衡常数比较分析判断反应进行方向;
(4)根据原电池工作原理写出该电池正极反应式;根据电流方向及O2-离子所带电荷判断O2-移动方向。
(1)根据反应热=反应物的总键能-生成物的总键能,所以氮气与氧气反应的反应热△H=(945+498)kJ/mol-2×630kJ/mol=+183kJ/mol,所以该反应的热化学方程式为N2(g)+O2(g)=2NO(g);△H=+183kJ/moL;
(2)根据2xCO+2NOx=2xCO2+N2,每生成1mol氮气,则转移电子的物质的量是4xmol,所以转移0.4xmol电子时,生成0.1mol氮气,标准状况下的体积是2.24L;
(3)①根据平衡常数的定义,该反应的平衡常数K=![]() ;
;
②A、升高温度,平衡逆向移动,甲醇的产率降低,错误;
B、将CH3OH(g)从体系中分离,则生成物的浓度减小,平衡正向移动,甲醇的产率增大,正确;
C、充入He,使体系总压强增大,但各物质的浓度不变,所以平衡不移动,甲醇的产率不变,错误;
D、再充入1 mol CO和3 mol H2,则反应物浓度增大,平衡正向移动,甲醇的产率增大,正确;
答案选BD;
③250℃时,Qc=![]() =0.8/0.43=12.5>2.041,则反应逆向进行,所以V正<V逆;
=0.8/0.43=12.5>2.041,则反应逆向进行,所以V正<V逆;
(4)甲醇燃料电池中,甲醇在负极发生氧化反应,氧气在正极发生还原反应,因为电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-离子,所以正极反应式是O2+4e-=2O2-,在原电池中阴离子向负极移动,所以O2-向负极移动。

【题目】煤化工中常需研究不同温度下平衡常数、投料比及产率等问题。已知:CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数随温度的变化如下表:下列叙述正确的是
CO2(g)+H2(g)的平衡常数随温度的变化如下表:下列叙述正确的是
温度/℃ | 400 | 500 | 830 | 1000 |
平衡常数K | 10 | 9 | 1 | 0.6 |
A. 该反应的正反应是吸热反应
B. 该反应达到平衡后,保持容器休积不变升高温度,正反应速率不变,容器内混合气体的压强不变
C. 830℃时,在恒容反应器中按物质的量比n(CO):n(H2O):n(H2):n(CO2)=2:4:6:1投入反应混合物发生上述反应,初始时刻v正<v逆
D. 830℃时,在2L的密闭容器中加入4molCO(g)和6molH2O(g)达到平衡时,CO的转化率是60%
【题目】结合下表回答下列问题:
物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
溶度积/25 ℃ | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
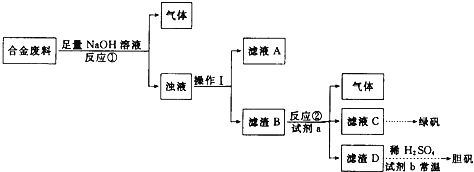
现有某酸性CuCl2溶液中含有少量的FeCl2,为得到纯净的CuCl2·2H2O晶体,按如图步骤进行提纯:
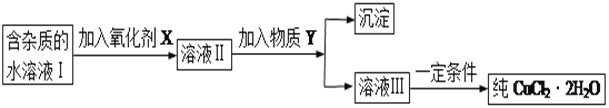
(1)最适合作氧化剂X的是_________(填字母),加入X的目的是____________________________________。
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
加入的物质Y是____________(填化学式),调至溶液pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=____________。过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2·2H2O晶体。
(2)在空气中直接加热CuCl2·2H2O晶体得不到纯的无水CuCl2,由CuCl2·2H2O晶体得到纯的无水CuCl2的合理方法是______________________________________________________。
(3)含Cr2O![]() 的废水毒性较大,某工厂废水中含5.0×10-3 mol·L-1的Cr2O
的废水毒性较大,某工厂废水中含5.0×10-3 mol·L-1的Cr2O![]() ,为了使废水的排放达标,进行如下处理:
,为了使废水的排放达标,进行如下处理:
![]()
①绿矾化学式为FeSO4·7H2O,反应(I)的离子方程式为________________________________;
②若处理后的废水中c(Cr3+)=3.0×10-6 mol·L-1,则废水中c(Fe3+)= _________ mol·L-1。(Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH) 3]=6.0×10-31)