题目内容
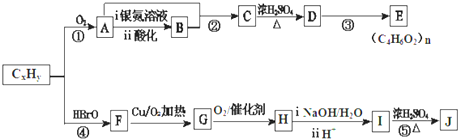
13.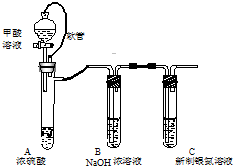 银氨溶液可用于检测CO气体,实验室研究的装置如图:
银氨溶液可用于检测CO气体,实验室研究的装置如图:已知:银氨溶液制备反应为:Ag++2NH3•H2O═[Ag(NH3)2]++2H2O.反应结束后试管C底部有黑色沉淀生成,分离出上层清液和底部黑色固体备用.
(1)甲酸(HCOOH)遇浓硫酸分解生成CO和H2O,该反应体现浓硫酸的脱水性(填“强氧化性”或“脱水性”).
(2)装置A中软管的作用是恒压,使甲酸溶液能顺利滴下.
(3)为验证上层清液中产物的成分,进行如下实验:
a.测得上层清液pH为10.
b.向上层清液中滴加几滴Ba(OH)2溶液,发现有白色浑浊出现,同时产生能使湿润红色石蕊试纸变蓝的气体.
c.取新制的银氨溶液滴加几滴Ba(OH)2溶液,无明显现象.
①实验c的目的是对比试验,排除银氨溶液对产物检验的干扰.
②根据上述实验现象判断,上层清液中产物成分为(NH4)2CO3或NH4+、CO32-(填化学符号).
(4)设计实验证明黑色固体的成分是Ag:可供选择的试剂有:浓硫酸、浓硝酸、NaOH溶液、NaCl溶液.
取少量上述黑色固体,用蒸馏水洗净,滴加浓硝酸,固体全部溶解并有少量红棕色气体产生,继续滴加NaCl溶液,能产生白色沉淀,说明黑色固体为单质银,说明黑色固体是Ag单质.(补充必要的实验内容及实验现象)
(5)从银氨溶液中回收银的方法是:向银氨溶液中加入过量盐酸,过滤,向沉淀AgCl中加入羟氨(NH2OH),充分反应后可得银,羟氨被氧化为N2.
①写出生成AgCl沉淀的离子反应Cl-+[Ag(NH3)2]++2H+=AgCl↓+2NH4+.
②若该反应中消耗6.6g羟氨,理论上可得银的质量为21.6g.
分析 (1)甲酸(HCOOH)遇浓硫酸分解生成CO和H2O,C元素的化合价不变,甲酸脱水;
(2)A中软管可使下方生成的气体的气压转移到液体的上方;
(3)①取新制的银氨溶液滴加几滴Ba(OH)2溶液,无明显现象,与b对比;
②由a可知溶液为碱性,由b、c可知b中生成白色沉淀为碳酸钡,气体为氨气,即试管C中反应生成碳酸铵;
(4)Ag与浓硝酸发生氧化还原反应生成硝酸银、二氧化氮;
(5)①银氨溶液与盐酸反应生成AgCl和氯化铵;
②AgCl中加入羟氨(NH2OH),发生氧化还原反应,遵循电子守恒.
解答 解:(1)甲酸(HCOOH)遇浓硫酸分解生成CO和H2O,C元素的化合价不变,甲酸脱水,则体现浓硫酸的脱水性,
故答案为:脱水性;
(2)A中软管可使下方生成的气体的气压转移到液体的上方,即其作用为恒压,使甲酸溶液能顺利滴下,
故答案为:恒压,使甲酸溶液能顺利滴下;
(3)①取新制的银氨溶液滴加几滴Ba(OH)2溶液,无明显现象,为b、c的对比试验,排除银氨溶液对产物检验的干扰,
故答案为:对比试验,排除银氨溶液对产物检验的干扰;
②由a可知溶液为碱性,由b、c可知b中生成白色沉淀为碳酸钡,气体为氨气,即试管C中HCOOH与银氨溶液反应生成碳酸铵,所以上层清液中产物成分为(NH4)2CO3或NH4+、CO32-,
故答案为:(NH4)2CO3或NH4+、CO32-;
(4)Ag与浓硝酸发生氧化还原反应生成硝酸银、二氧化氮,则证明黑色固体的成分是Ag的方法为取少量上述黑色固体,用蒸馏水洗净,滴加浓硝酸,固体全部溶解并有少量红棕色气体产生,继续滴加NaCl 溶液,能产生白色沉淀,说明黑色固体为单质银,
故答案为:滴加浓硝酸,固体全部溶解并有少量红棕色气体产生,继续滴加NaCl溶液,能产生白色沉淀,说明黑色固体为单质银;
(5)①银氨溶液与盐酸反应生成AgCl和氯化铵,该离子反应为Cl-+[Ag(NH3)2]++2H+=AgCl↓+2NH4+,
故答案为:Cl-+[Ag(NH3)2]++2H+=AgCl↓+2NH4+;
②AgCl中加入羟氨(NH2OH),发生氧化还原反应,消耗6.6g羟氨,n(NH2OH)=$\frac{6.6g}{33g/mol}$=0.2mol,由电子守恒可知,理论上可得银的质量为 $\frac{0.2mol×[0-(-1)]}{(1-0)}$×108g/mol=21.6g,
故答案为:21.6.
点评 本题考查性质实验方案的设计,为高频考点,题目难度中等,把握甲酸中含-CHO与银氨溶液的反应及产物的检验设计为解答的关键,试题侧重考查学生的分析能力、计算能力及化学实验能力.

| A. | 取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+ | |
| B. | 向1 mL 1%的NaOH溶液中加入2 mL 2%的CuSO4溶液,振荡后再加入0.5 mL有机物X,加热后未出现砖红色沉淀,说明X中不含有醛基 | |
| C. | 向CuSO4溶液中加入KI溶液,有白色沉淀生成,再加入四氯化碳振荡,四氯化碳层呈紫色,说明白色沉淀可能为CuI | |
| D. | 向浓度均为0.1 mol•L-1的MgCl2、CuCl2混合溶液中逐滴加入氨水,首先生成蓝色沉淀,说明Ksp[Cu(OH)2]>Ksp[Mg(OH)2] |
| 实验编号 | HA | NaOH | 混合后溶液的pH |
| 甲 | C(HA)=0.2mol•L-1 | C(NaOH)=0.2mol•L-1 | pH=a |
| 乙 | C(HA)=c1mol•L-1 | C(NaOH)=0.2mol•L-1 | pH=7 |
| 丙 | C(HA)=0.1mol•L-1 | C(NaOH)=0.1mol•L-1 | pH=9 |
| 丁 | pH=2 | pH=12 | pH=b |
(1)不考虑其他组的实验结果,单从甲组情况分析,如何用a(混合溶液的pH)来说明HA是强酸还是弱酸?若a=7,则HA是强酸;若a>7,则HA是弱酸.
(2)若考虑其他组的实验结果,则c1>(填“<”、“>”或“=”)0.2mol•L-1;乙组实验中HA和NaOH溶液混合前,HA溶液中C(A-)与NaOH溶液中C(Na+)的关系是B
A.前者大 B.后者大 C.二者相等 D.无法判断.
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是c(Na+)>c(A-)>c(OH-)>c(H+);其中,C(A-)=0.1+1×10-9-1×10-5mol•L-1(不能做近似计算,回答准确值,结果不一定要化简).
(4)丁组实验中,HA和NaOH溶液混合前后C(HA)>(填“<”、“>”或“=”)C(NaOH);b<7(填“<”、“>”或“=”)
| A. | Ca2+、K+、NO3-、Cl- | B. | Na+、Ba2+、Br-、SO32- | ||
| C. | H+、Na+、SiO32-、Cl- | D. | H+、Fe3+、I-、NO3- |
| A | ①能使溴的四氯化碳溶液褪色;②比例模型为 ;③能与水在一定条件下反应生成C ;③能与水在一定条件下反应生成C |
| B | ①由C、H两种元素组成;②球棍模型为 |
| C | ①由C、H、O三种元素组成;②能与Na反应,但不能与NaOH溶液反应;③能与E反应生成相对分子质量为100的酯 |
| D | ①相对分子质量比C少2;②能由C氧化而成. |
| E | ①由C、H、O三种元素组成;②球棍模型为 |
(1)A与溴的四氯化碳溶液反应的生成物的名称是1,2-二溴乙烷.
(2)A与氢气发生加成反应后生成物质F,与F在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2.当n=4时,这类有机物开始出现同分异构体.
(3)B具有的性质是②③(填序号).
①无色无味液体 ②有毒 ③不溶于水 ④密度比水大
⑤与酸性KMnO4溶液和溴水反应褪色 ⑥任何条件下不与氢气反应
写出在浓硫酸作用下,B与浓硝酸反应的化学方程式:
 .
.(4)据报道,最近摩托罗拉公司研制了一种由有机物C的同系物(该有机物的碳原子数比有机物C的碳原子数少1)和氧气以及强碱作电解质溶液的新型手机电池,电量可达现用镍氢电池或锂电池的10倍.该燃料电池的负极上的电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O,当外电路通过1.2mol e-时,理论上消耗该有机物为6.4g.
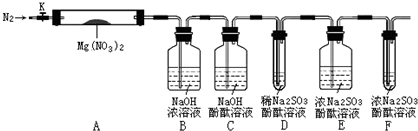
 ,步骤Ⅱ中,通入一段时间N2的目的是避免对分解产物O2的检验产生干扰.
,步骤Ⅱ中,通入一段时间N2的目的是避免对分解产物O2的检验产生干扰.

 .
.