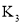题目内容
【题目】下列叙述中正确的是![]()
A.实验室欲配制![]() 的
的![]() 溶液,可用
溶液,可用![]() 胆矾及相应容器配制
胆矾及相应容器配制
B.将适量![]() 饱和溶液滴入沸水中并不断搅拌可制得氢氧化铁胶体
饱和溶液滴入沸水中并不断搅拌可制得氢氧化铁胶体
C.实验室中从海带里提取碘的过程是:灼烧![]() 溶解
溶解![]() 过滤
过滤![]() 萃取
萃取
D.用分液漏斗、烧杯、铁架台![]() 带铁圈
带铁圈![]() 、饱和
、饱和![]() 溶液可除去乙酸乙酯中的乙酸
溶液可除去乙酸乙酯中的乙酸
【答案】D
【解析】
A.依据![]() 计算需要溶质的质量;
计算需要溶质的质量;
B.搅拌能够使胶体聚沉;
C.碘以离子形式存在,需要加氧化剂氧化;
D.乙酸能够与碳酸钠溶液反应生成易溶于水的乙酸钠,乙酸乙酯不溶于饱和碳酸钠溶液。
![]() 实验室没有480mL的容量瓶,应选择大于480mL且规格相近的容量瓶,故应选择500mL容量瓶;需要胆矾的质量为
实验室没有480mL的容量瓶,应选择大于480mL且规格相近的容量瓶,故应选择500mL容量瓶;需要胆矾的质量为![]() ,故A错误;
,故A错误;
B.将适量![]() 饱和溶液滴入沸水中并不断搅拌,搅拌能够使胶体聚沉所以不能得到胶体,故B错误;
饱和溶液滴入沸水中并不断搅拌,搅拌能够使胶体聚沉所以不能得到胶体,故B错误;
C.碘以离子形式存在,需要加氧化剂氧化,则从海带提取单质碘的方法是:取样![]() 灼烧
灼烧![]() 溶解
溶解![]() 过滤
过滤![]() 氧化
氧化![]() 萃取,故C错误;
萃取,故C错误;
D.饱和![]() 溶液除去乙酸乙酯中的乙酸和乙醇,反应后分液,则给出的仪器可完成分液操作,故D正确;
溶液除去乙酸乙酯中的乙酸和乙醇,反应后分液,则给出的仪器可完成分液操作,故D正确;
故选:D。

 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案【题目】已知K2Cr2O7溶液中存在平衡:![]() +H2O
+H2O![]() 2
2![]() +2H+。K2Cr2O7为橙色,K 2CrO4为黄色。为探究浓度对化学平衡的影响,某兴趣小组设计了如下实验方案。
+2H+。K2Cr2O7为橙色,K 2CrO4为黄色。为探究浓度对化学平衡的影响,某兴趣小组设计了如下实验方案。
5mL0.1mol/LK2Cr2O7溶液 | 序号 | 试剂X |
ⅰ | 1mL1mol·L-1 K2Cr2O7 溶液 | |
ⅱ | 1mL1 mol·L-1 K2CrO4溶液 | |
ⅲ | 5~15滴浓硫酸 | |
ⅳ | 5~15滴浓盐酸 | |
ⅴ | 5~15滴6 mol·L-1 NaOH溶液 |
Ⅰ.方案讨论
(1)ⅰ~ⅴ中依据减少生成物浓度可导致平衡移动的原理设计的是_____(填序号)。
(2)已知BaCrO4为黄色沉淀。某同学认为试剂X还可设计为Ba(NO3)2溶液,加入该试剂后,溶液颜色将_____。(填“变深”、“变浅”或“不变”)。
Ⅱ.实验分析
序号 | 试剂X | 预期现象 | 实际现象 |
ⅰ | 1 mL1 mol·L-1 K2Cr2O7 溶液 | 溶液变黄 | 溶液橙色加深 |
ⅱ | 1mL1 mol·L-1 K2CrO | 溶液橙色加深 | 溶液颜色变浅 |
ⅲ | 5~15滴浓硫酸 | 溶液橙色加深 | 溶液橙色加深 |
ⅳ | 5~15滴浓盐酸 | 溶液橙色加深 | 无明显现象 |
ⅴ | 5~15滴6mol·L-1NaOH溶液 | 溶液变黄 | 溶液变黄 |
(1)实验ⅰ没有观察到预期现象的原因是_____,实验ⅱ的原因与其相似。
(2)通过实验ⅲ和ⅴ得出的结论为_____。
(3)实验ⅳ无明显现象,可能的原因是____________。
(4)某同学查阅资料发现:K2Cr2O7溶液与浓盐酸可发生氧化还原反应。但实验ⅳ中没有观察到明显现象,小组同学设计了下实验,验证了该反应的发生。
方案:取5 mL浓盐酸,向其中加入15滴0.1mol·L-1 K2Cr2O7溶液,一段时间后,溶液变为绿色(CrCl3水溶液呈绿色),有黄绿色气体生成。写出该变化的化学方程式______。
【题目】依据所给条件推出的结论不正确的是( )
选项 | 条件 | 结论 |
A | 在水溶液或熔融状态下可以导电的化合物,称为电解质 | 水中存在: |
B | 凡是能给出质子的分子或离子称为酸,凡是能接受质子的分子或离子称为碱 |
|
C | 联氨为二元弱碱,在水中的电离方式与氨相似 | 联氨与硫酸形成的酸式盐的化学式为: |
D | 发生化学反应时,接受电子对的物质为酸,提供电子对的物质为碱 |
|
A. AB. BC. CD. D