题目内容
【题目】锂-铜空气燃料电池容量高、成本低,具有广阔的发展前景。该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法不正确的是( )

A.放电时,正极的电极反应式为O2+2H2O+4e-=4OH-
B.放电时,Li+透过固体电解质向Cu极移动
C.通空气时,铜被腐蚀,表面产生Cu2O
D.整个反应过程中,氧化剂为O2
【答案】A
【解析】
试题分析:A.根据电池反应式知,正极反应式为 Cu2O+H2O+2e-=Cu+2OH-,A错误;B.放电时,阳离子向正极移动,则Li+透过固体电解质向Cu极移动,B正确; C.放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,因此通空气时,铜被腐蚀,表面产生Cu2O,C正确;D.通空气时,铜被腐蚀,表面产生Cu2O,放电时Cu2O转化为Cu,则整个反应过程中,铜相当于催化剂,氧化剂为O2,D正确;答案选A。

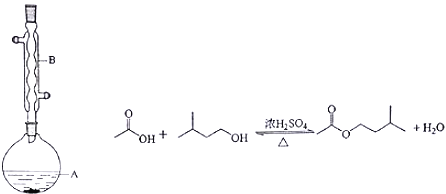
【题目】己二酸是合成尼龙-66的主要原料之一。实验室合成己二酸的原理、有关数据及装置示意图如图表: ![]()
物质 | 密度(20℃) | 熔点 | 沸点 | 溶解性 |
环己醇 | 0.962g/cm3 | 25.9℃ | 160.8℃ | 20℃时水中溶解度为3.6g,可混溶于乙醇、苯 |
己二酸 | 1.360g/cm3 | 152℃ | 337.5℃ | 在水中的溶解度:15℃时1.44g,25℃时2.3g,易溶于乙醇、不溶于苯 |

实验步骤如下:
Ⅰ.在三口烧瓶中加入16mL 50%的硝酸(密度为l.31g/cm3),再加入1~2粒沸石,滴液漏斗中盛放有5.4mL环己醇.
Ⅱ.水浴加热三口烧瓶至50℃左右,移去水浴,缓慢滴加5~6滴环己醇,摇动三口烧瓶,观察到有红棕色气体放出时再慢慢滴加剩下的环己醇,维持反应温度在60℃~65℃之间。
Ⅲ.当环己醇全部加入后,将混合物用80℃一90℃水浴加热约10min(注意控制温度),直至无红棕色气体生成为止。
Ⅳ.趁热将反应液倒入烧杯中,放入冰水浴中冷却,析出晶体后过滤、洗涤得粗产品。
V.粗产品经提纯后称重为5.7g
请回答下列问题:
(1)本实验所用50%的HNO3溶液物质的量浓度为 (保留一位小数),滴液漏斗中的细支管a作用是 。
(2)仪器b的名称为 ,其作用是 ,使用时要从 (填“上口”或“下口”)通入冷水。
(3)NaOH溶液的作用是 。溶液上方倒扣的漏斗的作用是 。
(4)向三口烧瓶中滴加环己醇时,反应温度迅速上升,为使反应温度不致过高,必要时可采取的措施是 。
(5)为了除去可能的杂质和减少产品损失,可分别用 和 洗涤晶体。