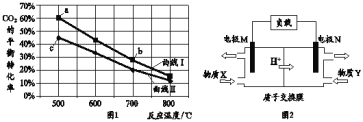
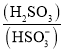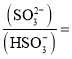题目内容
【题目】下列说法中不正确的是
A.σ键比π键的电子云重叠程度大,形成的共价键强
B.s-sσ键与s-pσ键的电子云形状对称性相同
C.丙烯(CH3—CH=CH2)分子有8个σ键,1个π键,其中碳原子分别是sp2、sp3杂化
D.N2分子中有一个σ键,2个π键;NH4+中4个N-H键的键能不相同
【答案】D
【解析】
A. σ键是电子云“头碰头”的方式重叠,π键是电子云“肩并肩”的方式重叠,σ键比π键的电子云重叠程度大,形成的共价键强,故A正确;
B. σ键有方向性,两个成键原子必须沿着对称轴方向接近,才能达到最大重叠,s-sσ键与s-pσ键都是轴对称的,所以s-s σ键与s-p σ键的电子云形状对称性相同,故B正确;
C. 丙烯(CH3—CH=CH2)分子有8个σ键,1个π键,其中双键碳原子sp2杂化、单键碳原子sp3杂化,故C正确;
D. N2分子的结构是![]() ,有一个σ键,2个π键,NH4+中N原子为sp3杂化,4个N-H键的键能完全相同,故D错误;
,有一个σ键,2个π键,NH4+中N原子为sp3杂化,4个N-H键的键能完全相同,故D错误;
答案选D。

练习册系列答案
 天天练口算系列答案
天天练口算系列答案
相关题目
【题目】破坏![]() 物质中的化学键所消耗的能量如表所示:
物质中的化学键所消耗的能量如表所示:
物质 |
|
|
|
|
|
|
|
能量/ | 243 | 193 | 151 | 431 | 363 | 297 | 436 |
根据上述数据回答下列问题。
(1)下列物质本身具有的能量最低的是________(填序号)。
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
(2)下列氢化物中,最稳定的是________(填序号)。
A. ![]() B.
B. ![]() C.
C. ![]()
(3)相同条件下,![]() (
(![]() 代表
代表![]() 、
、![]() 、
、![]() )分别与氢气反应,当消耗等物质的量的氢气时,放出或吸收的热量最多的是________。
)分别与氢气反应,当消耗等物质的量的氢气时,放出或吸收的热量最多的是________。