题目内容
12.设NA为阿伏伽德罗常数的值,下列说法正确的是( )| A. | 1 mol Cl2与足量的NaOH溶液反应,转移的电子数为1NA | |
| B. | 标况下,11.2L SO3所含的分子数目为0.5 NA | |
| C. | 5.6克铁粉与硝酸反应失去的电子一定为0.3NA | |
| D. | 50 mL 18.4 mol•L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA |
分析 A、氯气与氢氧化钠的反应为歧化反应;
B、标况下三氧化硫为固体;
C、求出铁的物质的量,然后根据当硝酸过量时铁变为+3价,而当铁过量时铁变为+2价来分析;
D、铜只能和浓硫酸反应,与稀硫酸不反应.
解答 解:A、氯气与氢氧化钠的反应为歧化反应,1mol氯气转移1mol电子即NA个,故A正确;
B、标况下三氧化硫为固体,故11.2L三氧化硫的物质的量大于0.5mol,则分子数大于0.5NA个,故B错误;
C、5.6g铁的物质的量为0.1mol,而当硝酸过量时铁变为+3价,但当铁过量时铁变为+2价,故0.1mol铁与硝酸反应后失去的电子可能为0.3NA个,也可能为0.2NA个,故C错误;
D、铜只能和浓硫酸反应,与稀硫酸不反应,故硫酸不能完全反应,故生成的二氧化硫的分子个数小于0.46NA个,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.

练习册系列答案
相关题目
2.卤代烃(CH3)2C═CHCl能发生的反应有( )
①取代反应 ②加成反应 ③消去反应 ④使溴水褪色
⑤使酸性KMnO4溶液褪色 ⑥与AgNO3溶液生成白色沉淀 ⑦加聚反应.
①取代反应 ②加成反应 ③消去反应 ④使溴水褪色
⑤使酸性KMnO4溶液褪色 ⑥与AgNO3溶液生成白色沉淀 ⑦加聚反应.
| A. | 以上反应均可发生 | B. | 只有③⑥不能发生 | ||
| C. | 只有①⑦不能发生 | D. | 只有②⑥不能发生 |
17.下列离子方程式正确的是( )
| A. | 硅酸钠溶液与足量CO2反应:SiO32-+CO2+H2O═H2SiO3↓+CO32- | |
| B. | FeBr2溶液中通入足量的Cl2:2Fe2++Cl2═2Fe3++2Cl- | |
| C. | 新制的氧化铝可溶于氢氧化钠溶液:Al2O3+2OH-═2AlO2-+H2O | |
| D. | 碳酸氢钠溶液中滴入足量氢氧化钙溶液:HCO3-+OH-═CO32-+H2O |
2.一定温度下,对于两个可逆反应A(g)+2B(g )?2C(g)和A(s)+2B(g)?2C(g),都能说明两个反应都已达到平衡的是( )
| A. | 容器内总压强不再变化 | B. | 混合气体的密度不再变化 | ||
| C. | 混合气体的平均摩尔质量不再变化 | D. | 混合气体的总质量不再变化 |
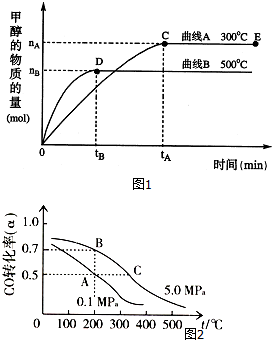 随着人类对环境和资源短缺等问题的重视,如何降低大气中有害气体的含量及对其有效地开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO来生产燃料甲醇.一定条件下的密闭容器中,CO和H2生成甲醇的反应:CO(g)+2H2(g)?CH3OH(g);
随着人类对环境和资源短缺等问题的重视,如何降低大气中有害气体的含量及对其有效地开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO来生产燃料甲醇.一定条件下的密闭容器中,CO和H2生成甲醇的反应:CO(g)+2H2(g)?CH3OH(g);