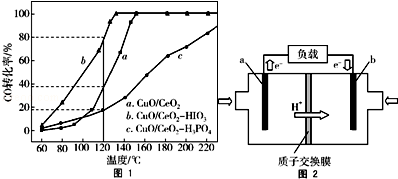
题目内容
2.一定温度下,对于两个可逆反应A(g)+2B(g )?2C(g)和A(s)+2B(g)?2C(g),都能说明两个反应都已达到平衡的是( )| A. | 容器内总压强不再变化 | B. | 混合气体的密度不再变化 | ||
| C. | 混合气体的平均摩尔质量不再变化 | D. | 混合气体的总质量不再变化 |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:A、对反应A(s)+2B(g)?2C(g)气体两边的计量数相等,所以容器内总压强不再变化,不能说明达平衡状态,故A错误;
B、对反应A(g)+2B(g )?2C(g),体积一定混合气体的密度始终不变,故B错误;
C、对于反应A(g)+2B(g )?2C(g)混合气体的平均摩尔质量不再变化,说明物质的量不变达平衡状态而对于反应A(s)+2B(g)?2C(g)混合气体的平均摩尔质量不再变化,说明气体的质量不变达平衡状态,故C正确;
D、对于反应A(g)+2B(g )?2C(g),混合气体的总质量始终不变,所以不能说明达平衡状态,故D错误;
故选C.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
12.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 1 mol Cl2与足量的NaOH溶液反应,转移的电子数为1NA | |
| B. | 标况下,11.2L SO3所含的分子数目为0.5 NA | |
| C. | 5.6克铁粉与硝酸反应失去的电子一定为0.3NA | |
| D. | 50 mL 18.4 mol•L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA |
10.高纯度的氢氧化镁广泛应用于医药、电力等领域.镁硅酸盐矿石可用于生产氢氧化镁,简要工艺流程如图1:

已知1:溶液Ⅰ中除MgSO4外,还含有少量Fe3+、Al3+、Fe2+等离子2:几种金属阳离子的氢氧化物沉淀时的pH如下表所示:
(1)向溶液Ⅰ中加入X的作用是调节溶液pH.
(2)向溶液Ⅰ中加入的两种试剂先后顺序是H2O2、MgO(填化学式).
(3)加入H2O2溶液反应的离子方程式是2Fe2++H2O2+2H+=2Fe3++2H2O.
(4)如图2是Mg2+转化率随温度t的变化示意图:
①t1前Mg2+转化率增大的原因是升高温度,Mg2+转化率增大,平衡右移,反应是吸热反应;t1后Mg2+转化率下降的原因是(用化学方程式表示)NH3•H2O$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O.
②向溶液Ⅱ中加入氨水反应的离子方程式是Mg2++2NH3•H2O=Mg(OH)2↓+2NH4+.

已知1:溶液Ⅰ中除MgSO4外,还含有少量Fe3+、Al3+、Fe2+等离子2:几种金属阳离子的氢氧化物沉淀时的pH如下表所示:
| Fe3+ | Al3+ | Fe2+ | Mg2+ | |
| 开始沉淀时 | 1.5 | 3.3 | 6.5 | 9.4 |
| 沉淀完全时 | 3.7 | 5.2 | 9.7 | 12.4 |
(2)向溶液Ⅰ中加入的两种试剂先后顺序是H2O2、MgO(填化学式).
(3)加入H2O2溶液反应的离子方程式是2Fe2++H2O2+2H+=2Fe3++2H2O.
(4)如图2是Mg2+转化率随温度t的变化示意图:
①t1前Mg2+转化率增大的原因是升高温度,Mg2+转化率增大,平衡右移,反应是吸热反应;t1后Mg2+转化率下降的原因是(用化学方程式表示)NH3•H2O$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O.
②向溶液Ⅱ中加入氨水反应的离子方程式是Mg2++2NH3•H2O=Mg(OH)2↓+2NH4+.
17.在密闭容器中,mA(g)+bB(g)?pC(g)反应平衡时,测得 c(A)为 0.5mol•L?1,温度不变的情况下,将容器体积增大一倍,当达到新的平衡时,测得 c(A)为 0.3mol•L?1,则下列判断中正确的是( )
| A. | 平衡向正反应方向移动 | B. | 物质C的体积分数增加 | ||
| C. | 化学计量数:m+b<p | D. | 物质B的转化率减小 |
11.下列有关仪器使用方法或实验操作正确的是( )
| A. | 洗净的锥形瓶和容量瓶可以放进烘箱中烘干 | |
| B. | 锥形瓶看用作加热的反应器 | |
| C. | 配制溶液定容时,俯视容量瓶刻度会使溶液浓度偏低 | |
| D. | 用98%,1.84g/mL的浓硫酸配制1mol/L,500mL的稀硫酸时,应用量简量取浓硫酸约27.17mL |
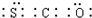 .反应I除生成两种正盐外,还有水生成,其化学方程式为COS+4NaOH=Na2S+Na2CO3+2H2O.已知反应II的产物X的溶液中硫元素的主要存在形式为S2O32-,则II中主要反应的离子方程式为2S2-+5H2O=S2O32-+4H2↑+2OH-.
.反应I除生成两种正盐外,还有水生成,其化学方程式为COS+4NaOH=Na2S+Na2CO3+2H2O.已知反应II的产物X的溶液中硫元素的主要存在形式为S2O32-,则II中主要反应的离子方程式为2S2-+5H2O=S2O32-+4H2↑+2OH-.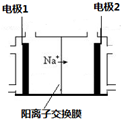 电解饱和食盐水是重要的化工产业,它被称为“氯碱工业”.在教材《化学1》、《化学2》、《化学反应原理》中均有提及,请写出电解饱和食盐水的化学反应方程式2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑,其中如图是《化学反应原理》中电解饱和食盐水工业中所采用的离子交换膜电解槽示意图,部分图标文字已被除去,请根据图中残留的信息(通电以后Na+的移动方向)判断电极2的名称是阴极,并写出电极1的电极反应式2Cl--2e-=Cl2↑.
电解饱和食盐水是重要的化工产业,它被称为“氯碱工业”.在教材《化学1》、《化学2》、《化学反应原理》中均有提及,请写出电解饱和食盐水的化学反应方程式2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑,其中如图是《化学反应原理》中电解饱和食盐水工业中所采用的离子交换膜电解槽示意图,部分图标文字已被除去,请根据图中残留的信息(通电以后Na+的移动方向)判断电极2的名称是阴极,并写出电极1的电极反应式2Cl--2e-=Cl2↑.