题目内容
4.(1)有一块表面被氧化成氧化钠的金属钠,质量是10.8g.将它投入到100g水中完全反应后,收集到0.2g氢气,试计算,被氧化成氧化钠的金属的质量是4.6g.(2)200℃时,11.6gCO2和水蒸气的混合气体与足量的Na2O2充分反应后固体质量增加了3.6g,求原混合物中CO2和H2O的物质的量比1:4.
分析 (1)根据2Na+2H2O=2NaOH+H2↑,利用氢气的量计算参加反应的钠的质量,然后得出氧化钠的质量,再计算出被氧化的钠的质量;
(2)向足量的固体Na2O2中通入11.6gCO2和H2O,发生反应:2Na2O2+2CO2=2Na2CO3+O2,2Na2O2+2H2O=4NaOH+O2↑,固体只增加3.6g,是因为生成O2,根据质量守恒定律可知m(O2)=11.6g-3.6g=8.0g,所以n(O2)=$\frac{8g}{32g/mol}$=0.25mol,令混合物中CO2和水蒸气的物质的量分别为为xmol,ymol,根据生成氧气的物质的量及二者之和,列方程计算.
解答 解:(1)设产生0.2g氢气需钠的质量为x
2Na+2H2O=2NaOH+H2↑
46 2
x 0.2g
$\frac{46}{2}=\frac{x}{0.2g}$
解得:x=4.6g,
则氧化钠的质量是:10.8g-4.6g=6.2g,
则对应的被氧化的钠的质量为$\frac{23×2}{23×2+16}$100%×6.2g=4.6g,
故答案为:4.6g;
(2)通入11.6gCO2和H2O,发生反应:2Na2O2+2CO2=2Na2CO3+O2,2Na2O2+2H2O=4NaOH+O2↑,固体只增加3.6g,是因为生成O2,根据质量守恒定律可知m(O2)=11.6g-3.6g=8.0g,所以n(O2)=$\frac{8g}{32g/mol}$=0.25mol,令混合物中CO2和水蒸气的物质的量分别为为xmol,ymol,
2Na2O2+2CO2=2Na2CO3+O2,
xmol 0.5xmol
2Na2O2+2H2O=4NaOH+O2↑
ymol 0.5ymol
所以$\left\{\begin{array}{l}{0.5x+0.5y=0.25}\\{44x+18y=11.6}\end{array}\right.$
解得:x=0.1,y=0.4
故原混合物中CO2和H2O的物质的量比为0.1mol:0.4mol=1:4,
故答案为:1:4.
点评 本题考查化学反应方程式的计算,为高频考点,把握发生的反应及反应中物质的量关系为解答的关键,侧重分析与计算能力的考查,题目难度不大.

 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案| A. | 每断裂1mol H-H键的同时断裂1mol I-I键 | |
| B. | 每断裂1mol I-I键的同时生成2mol H-I键 | |
| C. | 每消耗1molH2的同时消耗2molHI | |
| D. | 压强不发生改变 |
| A. | 1.0 L 1.0 mo1•L-1的NaAlO2 水溶液中含有的氧原子数为2 NA | |
| B. | 常温下,30 g SiO2晶体中含有Si-O键的数目为NA | |
| C. | 标准状况下,2.24 LCl2与足量水反应转移的电子数为0.2NA | |
| D. | V L a mol•L-1的氯化铁溶液中,若Fe3+的数目为NA,则Cl-的数目大于3NA |
| A. | 1 mol Cl2与足量的NaOH溶液反应,转移的电子数为1NA | |
| B. | 标况下,11.2L SO3所含的分子数目为0.5 NA | |
| C. | 5.6克铁粉与硝酸反应失去的电子一定为0.3NA | |
| D. | 50 mL 18.4 mol•L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA |

| A. | 装置①可用于分离C2H5OH和H2O的混合物 | |
| B. | 装置②可用于将海带灼烧成灰 | |
| C. | 装置③可用于除去氯气中的HCl | |
| D. | 装置④可用于实验室制取NO |
①单位时间内生成2n molA的同时生成2n molC
②单位时间内生成n molB 的同时,生成2n molA
③用A、C 的物质的量浓度变化表示的反应速率的比为1:1的状态
④混合气体的压强不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态.
| A. | ①④⑥ | B. | ②③⑤ | C. | ①④⑤⑥ | D. | ①⑤⑥ |
| A. | X、Y的转化率不相等 | |
| B. | 平衡时,Y和Z的生成速率之比为3:2 | |
| C. | c1:c2=1:3 | |
| D. | c1的取值范围为0<c1<0.14 mol•L-1 |
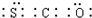 .反应I除生成两种正盐外,还有水生成,其化学方程式为COS+4NaOH=Na2S+Na2CO3+2H2O.已知反应II的产物X的溶液中硫元素的主要存在形式为S2O32-,则II中主要反应的离子方程式为2S2-+5H2O=S2O32-+4H2↑+2OH-.
.反应I除生成两种正盐外,还有水生成,其化学方程式为COS+4NaOH=Na2S+Na2CO3+2H2O.已知反应II的产物X的溶液中硫元素的主要存在形式为S2O32-,则II中主要反应的离子方程式为2S2-+5H2O=S2O32-+4H2↑+2OH-.