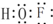题目内容
20.下列叙述中正确的是DEIJA.实验室存放HF的溶液,不能用带玻璃塞的细口瓶,而应用带橡胶塞的细口瓶.
B.碳酸氢镁溶液中加过量澄清石灰水的离子方程式为:
Ca2++Mg2++2OH-+2HCO3-=MgCO3↓+CaCO3↓+2H2O
C.水泥、玻璃和水晶都是硅酸盐产品
D.喝补铁剂时,加服维生素C,效果更好,原因是维生素C具有还原性
E.向新制的饱和氯水中分别加入CaCO3固体和Na2CO3固体,均会使得HClO的浓度增大
F.配制硫酸亚铁溶液时,为防止产生Fe3+,可在溶液中加入少量铁粉,为了抑制亚铁离子的水解,可在溶液中加入少量盐酸
G.无色溶液中,K+、Cl-、Na+、H2PO${\;}_{4}^{-}$、PO${\;}_{4}^{3-}$、SO${\;}_{4}^{2-}$可以大量共存
H.由水电离的c(H+)=10-12mol/L的溶液中,ClO-、HCO${\;}_{3}^{-}$、NO${\;}_{3}^{-}$、NH${\;}_{4}^{+}$、S2O${\;}_{3}^{2-}$可以大量共存
I.合金中一定有金属元素,两种不同的金属不一定可以加工成合金
J.某无色溶液含有下列离子中的若干种:H+、NH4+、Fe3+、Ba2+、Al3+、CO32-、Cl-、OH-、NO3-.向该溶液中加入铝粉,只放出H2,则溶液中能大量存在的离子最多有5种.
分析 A.HF能和二氧化硅反应生成四氟化硅和水;
B.氢氧化钙过量,反应生成碳酸钙和氢氧化镁沉淀;
C.水晶的主要成分是二氧化硅;
D.能被人体吸收的铁元素是亚铁离子,容易被氧化,维生素C具有还原性,可以防止亚铁离子被氧化;
E.向氯水中加入少量CaCO3固体和Na2CO3固体,会和溶液中的盐酸反应平衡正向进行,次氯酸酸性小于碳酸;
F.配制硫酸亚铁如有需要加入稀硫酸抑制水解;
G.H2PO4-、PO43-能反应;
H.由水电离的c(H+)=1×10-12mol/L的溶液,水的电离受到抑制,溶液可能呈酸性,也可能呈碱性;
I.合金是指在一种金属中加热熔合其它金属或非金属而形成的具有金属特性的物质;
J.溶液无色,则一定不存在有色的Fe3+;在其中加入金属铝,发生反应并放出H2,溶液可能呈酸性,也可能呈碱性,若为酸性,则不存在OH-、NO3-、CO32-,若呈碱性,则不存在Al3+、H+、NH4+、Fe3+.
解答 解:A.HF能和二氧化硅反应生成四氟化硅和水,所以HF不能用玻璃瓶存放,故A错误;
B.碳酸氢镁溶液中加过量澄清石灰水,反应的离子方程式为:Mg2++2HCO3-+2Ca2++4OH-=2CaCO3↓+2H2O+Mg(OH)2↓,故B错误;
C.水晶的主要成分是二氧化硅,玻璃、水泥的成分含有硅酸盐,是硅酸盐产品,故C错误;
D.能被人体吸收的铁元素是亚铁离子,亚铁离子很容易被氧化为三价铁离子,维生素C具有还原性,能将三价铁还原为亚铁离子,故D正确;
E.在化学平衡中:C12+H2O?H++C1-+HC1O,若向氯水中加入少量CaCO3固体和Na2CO3固体,会和溶液中的盐酸反应平衡正向进行,次氯酸酸性小于碳酸,不与碳酸钠反应,次氯酸浓度增大,故E正确;
F.配制硫酸亚铁如有需要加入稀硫酸抑制水解,加入适量稀盐酸会引入杂质氯离子,故F错误;
G.因H2PO4-、PO43-能反应生成HPO42-,则不能共存,故G错误;
H.由水电离的c(H+)=1×10-12mol/L的溶液,水的电离受到抑制,溶液可能呈酸性,也可能呈碱性,无论溶液呈酸性还是碱性,HCO3-都不能大量共存,故H错误.
I.合金中必须有一种金属,另外的可能是金属也可能是非金属,所以至少有一种金属;两种不同的金属不一定可以加工成合金,如当熔点较高的铜开始熔化时,钠已经是气体状态,所以不宜加工成合金,故I正确;
J.无色溶液中一定不存在有色的Fe3+;溶液中加入金属铝,发生反应并放出H2,溶液可能呈酸性,也可能呈碱性,
若溶液为酸性,则不存在:OH-、NO3-、CO32-,阴离子只能为Cl-,阳离子可以为:H+、NH4+、Ba2+、Al3+,最多存在5种离子;
若呈碱性,则不存在Al3+、H+、NH4+、Fe3+,阳离子只能为Ba2+,则一定不存在CO32-,可存在的离子为:Ba2+、Cl-、OH-、NO3-,则最多只有4种,
根据分析可知,最多存5种离子,故J正确.
故选DEIJ.
点评 本题考查化学实验方案的评价,为高频考点,涉及化学与生产、生活的关系,题目难度不大,要求学生能够用化学知识解释化学现象,试题培养了学生的分析、理解能力及灵活应用基础知识的能力.

| A. | 对农作物秸秆进行焚烧还田,以增加土壤肥力 | |
| B. | 推广使用无磷洗衣粉,以减少水体富营养化 | |
| C. | PM2.5是指大气中直径接近于2.5×10-6m(1m=109nm)的颗粒物,也称可吸入颗粒物,这些颗粒物分散在空气中形成的分散系是胶体 | |
| D. | 为提高农作物产量大量使用农药和化肥 |
[实验目的]验证臭氧的氧化性强于氧气.
[实验原理]2KI+O3+H2O═2KOH+I2+O2,淀粉溶液遇单质碘变蓝色.
[实验用品]臭氧消毒碗柜、a溶液、碘化钾溶液、滤纸、玻璃片、温度计.
[实验步骤]
①取a溶液与碘化钾溶液混合.
②取两片用滤纸剪成的纸条,在a和碘化钾的混合液中湿润后分别置于两块洁净的玻璃片上.
③将一块玻璃片(Ⅰ)置于臭氧消毒碗柜中并接通电源生成臭氧.将另一块玻璃片(Ⅱ)置于可控温度的温箱里,尽量地使温箱的温度与消毒碗柜中的温度相等.
④观察现象并进行记录:
| 时间/min | 0 | 15 | 30 | 45 | 60 | 90 | 120 | |
| 滤纸的 颜色 变化 | 玻璃片(Ⅰ) 上的滤纸 | 白色 | 白色 | 灰色 | 浅蓝色 | 蓝色 | 蓝色 | 浅蓝色 |
| 玻璃片(Ⅱ) 上的滤纸 | 白色 | 白色 | 白色 | 白色 | 灰色 | 灰色 | 浅蓝色 | |
(1)实验药品中的a溶液是淀粉溶液.
(2)写出在臭氧消毒柜中产生O3的化学方程式:3O2$\frac{\underline{\;通电\;}}{\;}$2O3.
(3)整个实验过程要保持两块玻璃片所在环境的温度相同的原因是温度会影响反应速率,保持温度相同是为了消除温度不同带来的误差.
(4)从实验数据记录可以得出的结论是BCD(填序号).
A.空气中可能也有一定浓度的O3,所以实验数据不可靠,不能达到实验目的
B.氧气也能氧化碘化钾中的碘离子
C.O3的氧化性比O2强
D.O3不仅氧化I-的速率比氧气快,而且有漂白作用
(5)在O3氧化KI的反应中,若有24g O3发生反应,则转移电子的数目为NA(或6.02×1023).
| A. | 1.0 L 1.0 mo1•L-1的NaAlO2 水溶液中含有的氧原子数为2 NA | |
| B. | 常温下,30 g SiO2晶体中含有Si-O键的数目为NA | |
| C. | 标准状况下,2.24 LCl2与足量水反应转移的电子数为0.2NA | |
| D. | V L a mol•L-1的氯化铁溶液中,若Fe3+的数目为NA,则Cl-的数目大于3NA |
| A. | 1 mol Cl2与足量的NaOH溶液反应,转移的电子数为1NA | |
| B. | 标况下,11.2L SO3所含的分子数目为0.5 NA | |
| C. | 5.6克铁粉与硝酸反应失去的电子一定为0.3NA | |
| D. | 50 mL 18.4 mol•L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA |
①单位时间内生成2n molA的同时生成2n molC
②单位时间内生成n molB 的同时,生成2n molA
③用A、C 的物质的量浓度变化表示的反应速率的比为1:1的状态
④混合气体的压强不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态.
| A. | ①④⑥ | B. | ②③⑤ | C. | ①④⑤⑥ | D. | ①⑤⑥ |

已知1:溶液Ⅰ中除MgSO4外,还含有少量Fe3+、Al3+、Fe2+等离子2:几种金属阳离子的氢氧化物沉淀时的pH如下表所示:
| Fe3+ | Al3+ | Fe2+ | Mg2+ | |
| 开始沉淀时 | 1.5 | 3.3 | 6.5 | 9.4 |
| 沉淀完全时 | 3.7 | 5.2 | 9.7 | 12.4 |
(2)向溶液Ⅰ中加入的两种试剂先后顺序是H2O2、MgO(填化学式).
(3)加入H2O2溶液反应的离子方程式是2Fe2++H2O2+2H+=2Fe3++2H2O.
(4)如图2是Mg2+转化率随温度t的变化示意图:
①t1前Mg2+转化率增大的原因是升高温度,Mg2+转化率增大,平衡右移,反应是吸热反应;t1后Mg2+转化率下降的原因是(用化学方程式表示)NH3•H2O$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O.
②向溶液Ⅱ中加入氨水反应的离子方程式是Mg2++2NH3•H2O=Mg(OH)2↓+2NH4+.
 氟及其化合物的发现史充满艰辛,现在氟及其化合物在生产生活中被广泛使用,造福人类.
氟及其化合物的发现史充满艰辛,现在氟及其化合物在生产生活中被广泛使用,造福人类.