题目内容
【题目】某化学兴趣小组对加碘食盐中碘酸钾进行研究,查阅资料得知:碘酸钾是一种白色粉末,常温下很稳定,加热至560℃开始分解。在酸性条件下碘酸钾是一种较强的氧化剂与HI、H2O2等物质作用,被还原为单质碘。
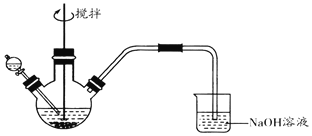
(1)学生甲设计实验测出加碘食盐中碘元素的含量,步骤如下:
①称取wg加碘盐,加适量蒸馏水溶解。
②用稀硫酸酸化所得的溶液,再加入过量KI溶液,写出该步反应的离子方程式:_______。
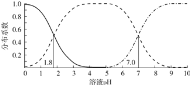
③以淀粉为指示剂,用物质的量浓度为1.00×10-3molL-1的Na2S2O3溶液滴定![]() 滴定时的反应方程式为
滴定时的反应方程式为![]() ,滴定时Na2S2O3溶液应放在 ______
,滴定时Na2S2O3溶液应放在 ______ ![]() 填“酸式滴定管”或“碱式滴定管”
填“酸式滴定管”或“碱式滴定管”![]() ,滴定至终点的现象为_______________。
,滴定至终点的现象为_______________。
(2)学生乙对纯净的NaCl(不含KIO3)进行了下列实验:
顺序 | 步骤 | 实验现象 |
① | 取少量纯净的NaCl,加适量蒸馏水溶解 | 溶液无变化 |
② | 滴入少量淀粉-KI溶液,振荡 | 溶液无变化 |
③ | 然后再滴加稀硫酸,振荡 | 溶液变蓝色 |
请推测实验③中产生蓝色现象的可能原因: __________________ ;根据学生乙的实验结果可推测学生甲的实验结果可能 ______ (填“偏大”、“偏小”或“无影响”)。
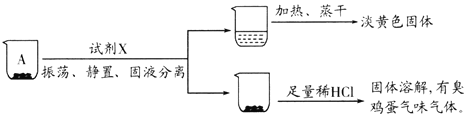
(3)学生丙设计实验证明加碘食盐样品中碘元素的存在形式是IO3-而不是I-,进行如下实验。写出实验步骤、预期现象和结论。限选试剂:稀硫酸、稀硝酸、3% H2O2溶液、新制氯水、1%淀粉溶液、蒸馏水。
实验步骤 | 预期现象和结论 |
步骤1:取少量食盐样品于试管中,加适量蒸馏水使其完全溶解, _____________________ | ______ |
步骤2:另取少量食盐样品于试管中,加适量蒸馏水使其完全溶解,滴入适量的稀硫酸酸化, _____________________ | ______ |
【答案】![]() 碱式滴定管 溶液由蓝色变成无色,且半分钟内不变色 I-在酸性条件下能被溶解在溶液中的氧气氧化成I2 偏大 加入几滴新制的氯水,再加入1-2滴1%淀粉溶液,充分振荡; 溶液不呈蓝色,则溶液中无I-,碘元素的存在形式不是I- 再加入少量3%H2O2溶液和1-2滴1%淀粉溶液,充分振荡 溶液呈蓝色,则溶液中存在IO3-,碘元素的存在形式为IO3-
碱式滴定管 溶液由蓝色变成无色,且半分钟内不变色 I-在酸性条件下能被溶解在溶液中的氧气氧化成I2 偏大 加入几滴新制的氯水,再加入1-2滴1%淀粉溶液,充分振荡; 溶液不呈蓝色,则溶液中无I-,碘元素的存在形式不是I- 再加入少量3%H2O2溶液和1-2滴1%淀粉溶液,充分振荡 溶液呈蓝色,则溶液中存在IO3-,碘元素的存在形式为IO3-
【解析】
(1)②用稀硫酸酸化所得的溶液,再加入过量KI溶液,反应生成碘单质;
③ Na2S2O3为强碱弱酸盐,S2O32-水解使溶液呈弱碱性;滴定结束前溶液为蓝色,![]() 反应完毕时溶液蓝色褪色;
反应完毕时溶液蓝色褪色;
(2)酸性条件下,碘离子被氧气氧化生成碘单质;甲同学的实验中,若用稀硫酸酸化,再加入过量KI溶液,由于碘单质的量增大;
(3)步骤1:氯气氧化性大于碘单质,用氯水检验食盐中存不存在碘离子,
步骤2:用双氧水和淀粉检验食盐中含有碘酸根离子;
(1)②用稀硫酸酸化所得的溶液,再加入过量KI溶液,反应生成碘单质,反应的离子方程式为:![]() ;
;
③ Na2S2O3为强碱弱酸盐,因为硫代硫酸根离子水解,Na2S2O3溶液呈弱碱性,所以滴定时Na2S2O3溶液应放在碱性滴定管中;滴定结束前溶液为蓝色,I2反应完毕时溶液蓝色褪色,则滴定终点现象为:溶液由蓝色变成无色,且半分钟内不变色;
(2)酸性条件下,碘离子被氧气氧化生成碘单质,离子反应方程式为:![]() ,在酸性条件下,过量的碘离子易被空气中氧气氧化生成碘单质;甲同学的实验中,若用稀硫酸酸化,再加入过量KI溶液,由于碘单质的量增大,导致测定结果偏大;
,在酸性条件下,过量的碘离子易被空气中氧气氧化生成碘单质;甲同学的实验中,若用稀硫酸酸化,再加入过量KI溶液,由于碘单质的量增大,导致测定结果偏大;
(3)步骤1:氯气氧化性大于碘单质,用氯水检验食盐中存不存在碘离子,操作方法及现象为:取少量食盐样品于试管中,加适量蒸馏水使其完全溶解,加入几滴新制的氯水,再加入1-2滴1%淀粉溶液,充分振荡,若溶液不呈蓝色,则溶液中无I-,碘元素的存在形式不是I-;
步骤2:用双氧水和淀粉检验食盐中含有碘酸根离子,操作方法及现象为:另取少量食盐样品于试管中,加适量蒸馏水使其完全溶解,滴入适量的稀硫酸酸化,再加入少量3%H2O2溶液和1-2滴1%淀粉溶液,充分振荡,若溶液呈蓝色,则溶液中存在IO3-,碘元素的存在形式为IO3-。

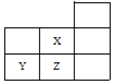
【题目】如图是元素周期表的一部分:
数据编号 | 滴入NaOH溶液的体积 | 溶液的pH | |
HX | HZ | ||
1 | 0 | 3 | 1 |
2 |
| a | b |
![]() 时,用浓度为
时,用浓度为![]() 的氢氧化钠溶液分别滴定
的氢氧化钠溶液分别滴定![]() 浓度均为
浓度均为![]() 的两种酸HX、
的两种酸HX、![]() 忽略体积变化
忽略体积变化![]() ,实验数据如表2,下列判断正确的是
,实验数据如表2,下列判断正确的是![]()
A.通过分析可得表格中![]() ,
,![]()
B.将上述的HZ溶液稀释100倍后pH比HX溶液的pH大
C.由于Z元素的非金属性比Y强,所以Z氢化物的酸性较强
D.![]()
![]()
![]() 的水溶液中:
的水溶液中:![]()
![]()
【题目】工业上可用水煤气(CO和H2)合成一系列有机物。
(1)根据下图写出固态碳和水蒸气反应生成CO和H2的热化学方程式:_________________________________________________。

(2)已知
① 2H2 (g)+CO(g) ![]() CH3OH (g) ΔH1
CH3OH (g) ΔH1
② 2CH3OH(g) ![]() CH3OCH3(g)+H2O(g) ΔH2
CH3OCH3(g)+H2O(g) ΔH2
③ CO(g)+H2O(g) ![]() CO2 (g)+H2(g) ΔH3
CO2 (g)+H2(g) ΔH3
则3H2(g)+3CO(g) ![]() CH3OCH3(g)+CO2 (g) ΔH=_________(用ΔH1、 ΔH2、ΔH3列出表达式)。
CH3OCH3(g)+CO2 (g) ΔH=_________(用ΔH1、 ΔH2、ΔH3列出表达式)。
(3)一定条件下的密闭容器中,3H2(g)+3CO(g) ![]() CH3OCH3(g)+CO2 (g) ΔH=a kJ·mol-1 (a<0)
CH3OCH3(g)+CO2 (g) ΔH=a kJ·mol-1 (a<0)
反应达到平衡后,要提高CO的转化率,可以采取的措施是______(填字母代号)。
A.高温 B.加入催化剂 C.高压 D.分离出二甲醚
(4)已知2CH3OH(g) ![]() CH3OCH3(g)+H2O(g)在某温度下的平衡常数K = 4。此温度下,在密闭容器中加入CH3OH,反应到20min时测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)在某温度下的平衡常数K = 4。此温度下,在密闭容器中加入CH3OH,反应到20min时测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
c / mol·L-1 | 0.4 | 0.1 | 0.1 |
①此时,反应向___________ (填“左”或“右”)移动,才能达到平衡。
②从加入CH3OH开始反应到20min时,CH3OCH3的生成速率为_____________。
③达到平衡后CH3OH的浓度为_____________。