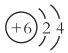题目内容
【题目】向纯水中加入少量的硫酸氢钠固体(温度不变),则溶液的 ( )
A.pH升高B.酸性增强C.c(OH一)增大D.水中c(H+)与c(OH-)的乘积增大
【答案】B
【解析】
水的电离平衡为:H2O![]() H++OH-,加入少量的NaHSO4固体,溶液中氢离子浓度增大,抑制了水的电离,
H++OH-,加入少量的NaHSO4固体,溶液中氢离子浓度增大,抑制了水的电离,
A、加入硫酸氢钠后,溶液中氢离子浓度增大,溶液的pH减小,故A错误;
B、加入硫酸氢钠后,溶液中氢离子浓度增大,溶液的pH减小,酸性增强,故B正确;
C、硫酸氢钠电离出氢离子,水的电离平衡向着逆向移动,溶液中氢离子浓度增大,溶液pH减小,c(OH一)减小,故C错误;
D、由于温度不变,水的离子积不变,即c (H+) 和c (OH-) 的乘积不变,故D错误;
故选B。

 阅读快车系列答案
阅读快车系列答案【题目】在一定条件下发生反应:4NO2(g)+O2(g)![]() 2N2O5(g) ΔH<0,T1时,向体积为2L的恒容密闭容器中通入NO2和O2,部分实验数据如表所示。
2N2O5(g) ΔH<0,T1时,向体积为2L的恒容密闭容器中通入NO2和O2,部分实验数据如表所示。
时间/s | 0 | 5 | 10 | 15 |
c(NO2)/(mol·L-1) | 4.00 | 2.52 | 2.00 | c3 |
c(O2)/(mol·L-1) | 1.00 | c1 | c2 | 0.50 |
(1)0~10s内N2O5的平均反应速率为__ ,此温度下的平衡常数为___。
(2)其他条件不变,将容器体积压缩一半,则重新达到平衡时c(N2O5)___2.00mol·L-1(填“>、<或=”,下同)
(3)假设温度T1时平衡常数为K1,温度T2时平衡常数为K2,若K1<K2,则T1____T2。
(4)下列可以作为平衡的依据的是___
A.容器内混合气体的颜色不再改变
B.生成1molO2的同时消耗2molN2O5
C.混合气体的平均摩尔质量不再变化
D.混合气体的密度不再变化
(5)改变哪些措施可以增加NO2的平衡转化率___(答出任意两条及以上)
(6)已知:N2(g)+O2(g)=2NO(g) ΔH=+180.5 kJ·mol1
2C(s)+O2(g)=2CO(g) ΔH=﹣221.0 kJ·mol1
C(s)+O2(g)=CO2(g) ΔH=﹣393.5 kJ·mol1
则汽车尾气处理的反应之一:2NO(g)+2CO(g)=N2(g)+2CO2(g) ΔH=___ kJ·mol1,利于该反应自发进行的条件是___(选填“高温”或“低温”)。
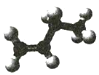
【题目】已知表中是某些有机物的模型图,根据要求回答下列问题:
有机物 | 甲 | 乙 | 丙 |
模型 |
|
|
|
(1)甲的分子式是___________________,其一氯代物有___________________种。
(2)写出乙与![]() 的
的![]() 溶液发生反应的化学方程式:______________________________________,该反应的反应类型是___________________。
溶液发生反应的化学方程式:______________________________________,该反应的反应类型是___________________。
(3)丙的摩尔质量为![]() ,则用苯制备该物质时的催化剂是___________________。
,则用苯制备该物质时的催化剂是___________________。