题目内容
“神七”登天谱写了我国航天事业的新篇章。火箭升空需要高能的燃料,通常用肼(N2H4)作为燃料,N2O4做氧化剂。
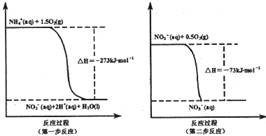
(1)已知:N2(g) + 2O2(g) =2NO2(g) △H=+67.7 kJ·mol-1
N2H4(g) + O2(g) =N2(g) + 2H2O(g) △H=-534.0 kJ·mol-1
2NO2(g) N2O4(g) △H=-52.7 kJ·mol-1
N2O4(g) △H=-52.7 kJ·mol-1
试写出气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式: 。
(2)工业上可用次氯酸钠与过量的氨反应制备肼,该反应的化学方程式为: 。
(3)一定条件下,在2L密闭容器中起始投入2 mol NH3和4 mol O2发生反应:
4NH3(g)+5O2(g) 4NO(g)+6H2O(g) ΔH<0
4NO(g)+6H2O(g) ΔH<0
测得平衡时数据如下:
| 平衡时物质的量(mol) | n(NO) | n(H2O) |
| 温度T1 | 1.6 | 2.4 |
| 温度T2 | 1.2 | 1.8 |
①在温度T1下,若经过10min反应达到平衡,则10min内反应的平均速率
v(NH3)= 。
②温度T1和T2的大小关系是T1 T2(填“>”、 “<”或“=”)。
(4)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料。已知该反应的阳极反应为:
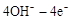 =O2↑+2H2O,则阴极反应为 。有人提出,可以设计反应2CO=2C+O2(△H>0)来消除CO的污染。请你判断上述反应是否能自发进行并说明理由 。
=O2↑+2H2O,则阴极反应为 。有人提出,可以设计反应2CO=2C+O2(△H>0)来消除CO的污染。请你判断上述反应是否能自发进行并说明理由 。(5)下图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH溶液为电解液。
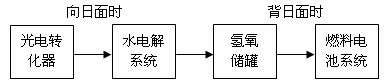
如果某段时间内氢氧储罐中共收集到33.6L气体(已折算成标准状况),则该段时间内水电解系统中转移电子的物质的量为 mol。
(14分)
(1)2N2H4(g) + N2O4(g)=3N2(g) + 4H2O(g) △H=-1083.0 kJ·mol-1 (2分)
(2)NaClO + 2 NH3 =N2H4 + NaCl + H2O (2分)
(3)0.08 mol?L—1 ?min—1 (2分) < (2分)
(4)2CO2+4e—+2H2O=2CO+4OH—(或CO2+2e—+H2O=CO+2OH—)(2分)
不能,因为该反应的△H>0,△S<O(2分)
(5)2 (2分)
解析试题分析:⑴由盖斯定律:①N2(g) + 2O2(g) =2NO2(g) △H1=+67.7 kJ·mol-1
②N2H4(g) + O2(g) =N2(g) + 2H2O(g) △H2=-534.0 kJ·mol-1
③2NO2(g)  N2O4(g) △H3=-52.7 kJ·mol-1
N2O4(g) △H3=-52.7 kJ·mol-1
②×2―①―③得:△H=2△H2―△H1―△H3=-534.0 kJ·mol-1×2―67.7 kJ·mol-1 +52.7 kJ·mol-1=-1083.0 kJ·mol-1,答案: 2N2H4(g) + N2O4(g)=3N2(g) + 4H2O(g) △H=-1083.0 kJ·mol-1;⑵用氧化还原反应的思想,分析出氧化剂为NaClO,还原产物为NaCl,还原剂为NH3,氧化产物为N2H4,答案:NaClO + 2 NH3 =N2H4 + NaCl + H2O;⑶①由4NH3(g)+5O2(g) 4NO(g)+6H2O(g) 的计量数关系得速率:v(NH3)=v(NO)=
4NO(g)+6H2O(g) 的计量数关系得速率:v(NH3)=v(NO)= ,该反应是放热反应,NO在T2时物质的量少,说明进行的程度小,T2高于T1,答案:0.08 mol?L—1 ?min—1, <;⑷用总反应2CO2=2CO+O2,减去阳极反应式
,该反应是放热反应,NO在T2时物质的量少,说明进行的程度小,T2高于T1,答案:0.08 mol?L—1 ?min—1, <;⑷用总反应2CO2=2CO+O2,减去阳极反应式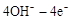 =O2↑+2H2O,得2CO2+4e—+2H2O=2CO+4OH—,答案:2CO2+4e—+2H2O=2CO+4OH—;2CO2=2CO+O2,△S小于0,△H大于0 ,△G=△H―T△S>0,所以反应不能自发,答案:不能自发,因为该反应的△H>0,△S<O。
=O2↑+2H2O,得2CO2+4e—+2H2O=2CO+4OH—,答案:2CO2+4e—+2H2O=2CO+4OH—;2CO2=2CO+O2,△S小于0,△H大于0 ,△G=△H―T△S>0,所以反应不能自发,答案:不能自发,因为该反应的△H>0,△S<O。
考点:以新能源、新材料为背景涉及元素化合物性质、热化学方程式和电极反应方程式的书写、读图读表计算与分析的综合题

 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案(16分)最近全国各地持续出现雾霾天气,其首要污染物是可吸入颗粒物PM2.5和氮、硫的氧化物(PM2.5直径接近2.5×10-6m,1纳米=10-9m),主要来源为工业废气、机动车尾气等。因此对PM2.5、SO2、NOx进行研究、处理意义重大。
(1) 下列关于PM2.5说法正确的是
a.PM2.5在空气中形成了胶体;
b.PM2.5表面积大,能吸附大量有毒、有害物质;
c.少开私家车,尽量选择公交、地铁出行,某种程度可以减少PM2.5污染
(2) 取PM2.5样本用蒸馏水处理制得试样,若测得该试样所含水溶性无机离子及其平均
浓度如下表
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/ mol/L | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
(3)对汽车尾气中的NOx进行研究
①NOx能形成酸雨,写出NO2转化为HNO3的化学方程式 。
②汽车尾气系统中装有催化转化器,可将NOx还原成N2排出,已知下列热化学方程式:
ⅰ N2(g) +O2(g)
 2NO(g) △H=+180.5kJ·mol-1
2NO(g) △H=+180.5kJ·mol-1 ⅱ 2C(s)+ O2(g)
 2CO(g) △H ="-" 221.0 kJ·mol-1
2CO(g) △H ="-" 221.0 kJ·mol-1ⅲ C(s)+ O2(g)
 CO2( g) △H ="-" 393.5 kJ·mol-1
CO2( g) △H ="-" 393.5 kJ·mol-1温度升高,反应ⅲ化学平衡常数 。(填“增大”或“减小”或“不变”)
写出NO(g)和CO(g) 反应生成N2(g) CO2(g)的热化学方程式 。
(4)将工厂废气中产生的SO2通过下列流程,可以转化为有应用价值的硫酸钙等
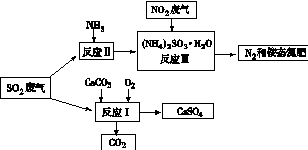
①写出反应Ⅰ的化学方程式: 。
②生产中,向反应Ⅱ的溶液中加入强还原性的对苯二酚等物质,目的是 。
③检验经过反应Ⅲ得到的氨态氮肥中SO42-所用试剂是 。
能源短缺是人类面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。因此甲醇被称为21世纪的新型燃料。
(1)已知在常温常压下:
①2CH3OH(l)+3O2(g) 2CO2(g)+4H2O(g) △H= -1275.6 kJ·mol—1
②H2O(l) H2O(g) △H="+" 44.0 kJ.mo—1
写出表示甲醇燃烧热的热化学方程式 。
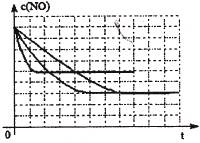
(2)工业上用CO生产燃料甲醇。一定条件下发生反应:CO(g)+2H2(g) CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化图。
CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化图。
①在“图1”中,曲线 (填“a”或“b”)表示使用了催化剂。
②能判断该反应在“图2”所在条件下是否已达化学平衡状态的依据是 。(双选)
| A.容器中压强不变 | B.体系的密度不随时间改变 |
| C.v正(H2)=2v逆(CH3OH) | D.CO与H2的物质的量的比不随时间改变 |
 CH3OH(g)的化学平衡常数K= 。
CH3OH(g)的化学平衡常数K= 。④请在“图3”中画出平衡时甲醇百分含量(纵坐标)随温度(横坐标)变化的曲线,要求画压强不同的2条曲线(在曲线上标出P1、P2,且P1<P2)。
(3)CaSO4是一种微溶物质,已知Ksp(CaSO4)=9.10×10-6。现将c mol·L-1 CaCl2溶液与2.00×10-2 mol·L-1 Na2SO4溶液等体积混合生成沉淀,则c的最小值是 (结果保留3位有效数字)。
 2CO2+ N2 △H
2CO2+ N2 △H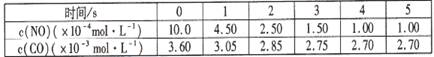



 H++ SO42-
H++ SO42-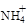 的废水会发生如下反应:
的废水会发生如下反应:
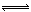 CH3OH(g)。
CH3OH(g)。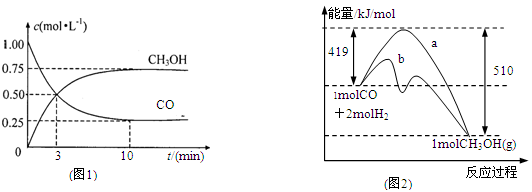
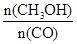 增大的有
增大的有  2NH3(g) △H <0
2NH3(g) △H <0
 CO+H2;②CO+H2O(g)
CO+H2;②CO+H2O(g) 