题目内容
(I某氮肥厂氨氮废水中的氮元素多以NH4+和NH3·H2O的形式存在。在微生物作用下,NH4+经过两步反应被氧化成NO3-,两步反应的能量变化示意图如下: 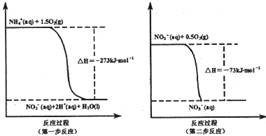
(1)1 mo1NH4+(aq)全部氧化成NO3-(aq)的热化学方程式是 _ 。
(2)在一定条件下,向废水中加入CH3OH,将HNO3还原成 N2,若该反应消耗32gCH3OH转移6mol电子,则参加反应的还原剂和氧化剂的物质的量之比是_ 。
(B)超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术
将尾气中的NO和CO转变成CO2和N2,化学方程式如下:2NO十2CO 2CO2+ N2 △H
2CO2+ N2 △H
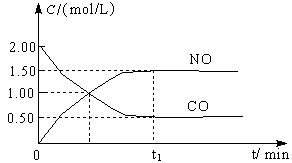
某温度下用气体传感器测得不同的时间的NO和CO浓度如下表: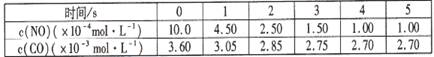
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)在上述条件下反应能够自发进行,则反应的△H 0(填写“>”、“<”、“=”)
(2)在该温度下,反应的平衡常数K= (只写出计算结果);
(3)某同学设计了三组实验,分别验证温度、催化剂比表面积对化学反应速率的影响规律,
部分实验条件如下表:
该同学画出了表中三个实验条件下,混合气体中NO浓度随时间变化的趋势曲线图,请在图上标明各条曲线的实验编号; 
(I)(1)NH4+(aq)+2O2(g)=2H+(aq)+NO3-(aq)+H2O(l)
△H=-346kJ·mol-1
(2)5:6
(Ⅱ)(1)<
(2)5000
(3)见图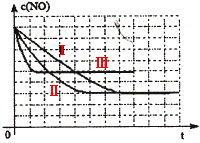
解析试题分析:(I)(1)NH4+(aq)+2O2(g)=2H+(aq)+NO3-(aq)+H2O(l)
1 mo1NH4+(aq)全部氧化成NO3-(aq)的热化学方程式中△H为第一步反应和第二部反应之和即为:-346kJ·mol-1;(2)32gCH3OH的物质的量为1mol,转移电子6mol表示氧化剂HNO3得到6mol电子,由于HNO3中N元素有+5价将为N2中的0价因此需要1.2molHNO3参与反应。因此参加反应的还原剂CH3OH和氧化剂HNO3的物质的量之比是5:6。
(Ⅱ)(1)此反应为气体体积缩小的反应△S<0,由于反应能够自发进行因此△G=△H-T△S<0,因此
△H<0
(2) 2NO + 2CO  2CO2 + N2
2CO2 + N2
始:10.0×10-4 3.6×10-3 0 0
变:9.00×10-4 9.00×10-4 9.00×10-4 4.50×10-4
终:1.00×10-4 2.7×10-3 9.00×10-4 4.50×10-4
由公式计算可得K=5000
(3)Ⅱ对比I增加了催化剂的比表面积,催化剂只会缩短达到平衡的时间并不影响平衡的移动;Ⅲ对比Ⅱ提高了反应的温度,平衡向吸热方向移动,即向逆反应方向移动c(NO)提高。
考点:热化学方程式和化学平衡的有关分析和计算。

 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案图a是1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化示意图,图b是反应中的CO和NO的浓度随时间变化的示意图。根据图意回答下列问题: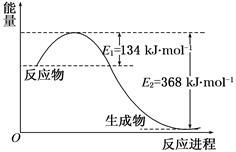
a b
(1)写出NO2和CO反应的热化学方程式 。
(2)从反应开始到平衡,用NO2浓度变化表示平均反应速率v(NO2)= 。
(3)此温度下该反应的平衡常数K= ;温度降低,K (填“变大”、“变小”或“不变”)
(4)若在温度和容积相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡吋的有关数据如下表:
| 容 器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1 mol NO2 1 mol CO | 2 mol NO 2 mol CO2 | 1 mol NO2、1 mol CO 1 mol NO、1 mol CO2 |
| 平衡时c(NO) /mol·L-1 | 1.5 | 3 | m |
| 能量变化 | 放出a kJ | 吸收b kJ | 放出c kJ |
| CO或NO的转化率 | α1 | α2 | α3 |
则:α1+α2= , a+b/2= ,m=
黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其燃烧产物为SO2和Fe2O3。
(1)已知1g FeS2完全燃烧放出7.1kJ热量,则表示FeS2完全燃烧反应的热化学方程式为:
______________________________________________________________。
(2)将0.050molSO2(g)和0.030molO2(g)放入容积为1L的密闭容器中,反应:2SO2(g)+O2(g)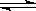 2SO3(g) 在一定条件下达到平衡,测得c(SO3)=0.040mol/L。则该条件下反应的平衡常数K的数值为___________,SO2的平衡转化率为__________。
2SO3(g) 在一定条件下达到平衡,测得c(SO3)=0.040mol/L。则该条件下反应的平衡常数K的数值为___________,SO2的平衡转化率为__________。
(3)当该反应处于平衡状态时,欲使平衡向正反应方向移动且反应速率加快,下列措施可行的是 。(填字母)
| A.向平衡混合物中充入Ar | B.向平衡混合物中充入O2 |
| C.改变反应的催化剂 | D.降低反应的温度 |
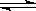 2SO3(g) △H<0 , SO2的转化率在起始温度T1=673K下随反应时间(t)的变化如下图,其他条件不变,仅改变起始温度为T2=723K,请在图中画出温度T2下SO2的转化率随反应时间变化的预期结果示意图。
2SO3(g) △H<0 , SO2的转化率在起始温度T1=673K下随反应时间(t)的变化如下图,其他条件不变,仅改变起始温度为T2=723K,请在图中画出温度T2下SO2的转化率随反应时间变化的预期结果示意图。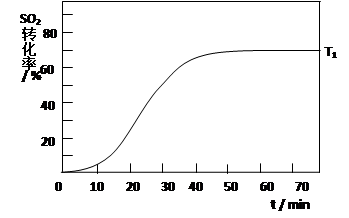
“神七”登天谱写了我国航天事业的新篇章。火箭升空需要高能的燃料,通常用肼(N2H4)作为燃料,N2O4做氧化剂。
(1)已知:N2(g) + 2O2(g) =2NO2(g) △H=+67.7 kJ·mol-1
N2H4(g) + O2(g) =N2(g) + 2H2O(g) △H=-534.0 kJ·mol-1
2NO2(g) N2O4(g) △H=-52.7 kJ·mol-1
N2O4(g) △H=-52.7 kJ·mol-1
试写出气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式: 。
(2)工业上可用次氯酸钠与过量的氨反应制备肼,该反应的化学方程式为: 。
(3)一定条件下,在2L密闭容器中起始投入2 mol NH3和4 mol O2发生反应:
4NH3(g)+5O2(g) 4NO(g)+6H2O(g) ΔH<0
4NO(g)+6H2O(g) ΔH<0
测得平衡时数据如下:
| 平衡时物质的量(mol) | n(NO) | n(H2O) |
| 温度T1 | 1.6 | 2.4 |
| 温度T2 | 1.2 | 1.8 |
①在温度T1下,若经过10min反应达到平衡,则10min内反应的平均速率
v(NH3)= 。
②温度T1和T2的大小关系是T1 T2(填“>”、 “<”或“=”)。
(4)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料。已知该反应的阳极反应为:
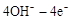 =O2↑+2H2O,则阴极反应为 。有人提出,可以设计反应2CO=2C+O2(△H>0)来消除CO的污染。请你判断上述反应是否能自发进行并说明理由 。
=O2↑+2H2O,则阴极反应为 。有人提出,可以设计反应2CO=2C+O2(△H>0)来消除CO的污染。请你判断上述反应是否能自发进行并说明理由 。(5)下图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH溶液为电解液。
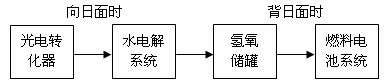
如果某段时间内氢氧储罐中共收集到33.6L气体(已折算成标准状况),则该段时间内水电解系统中转移电子的物质的量为 mol。
 2SO3(g),反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ/mol。
2SO3(g),反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ/mol。
 2SO3(g) △H<0反应,某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如下图所示,根据图示回答下列问题:
2SO3(g) △H<0反应,某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如下图所示,根据图示回答下列问题:
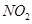 、
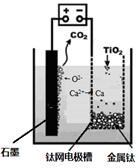
、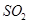 、CO等大气污染气体的测量及处理具有重要意义。
、CO等大气污染气体的测量及处理具有重要意义。 可使
可使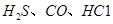 等氧化,常用于定量测定CO的含量。已知:
等氧化,常用于定量测定CO的含量。已知: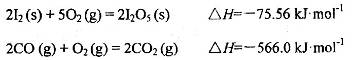
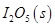 反应生成
反应生成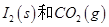 的热化学方程式:________________。
的热化学方程式:________________。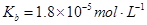

 ________2(填“>”“<”或“=”)
________2(填“>”“<”或“=”)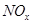 可用强碱溶液吸产生硝酸盐。在酸性条件下,FeSO4溶液能将
可用强碱溶液吸产生硝酸盐。在酸性条件下,FeSO4溶液能将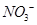 还原为NO,写出该过程中产生NO反应的离子方程式___________________________________。
还原为NO,写出该过程中产生NO反应的离子方程式___________________________________。