题目内容
能源短缺是人类面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。因此甲醇被称为21世纪的新型燃料。
(1)已知在常温常压下:
①2CH3OH(l)+3O2(g) 2CO2(g)+4H2O(g) △H= -1275.6 kJ·mol—1
②H2O(l) H2O(g) △H="+" 44.0 kJ.mo—1
写出表示甲醇燃烧热的热化学方程式 。
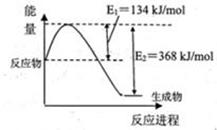
(2)工业上用CO生产燃料甲醇。一定条件下发生反应:CO(g)+2H2(g) CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化图。
CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化图。
①在“图1”中,曲线 (填“a”或“b”)表示使用了催化剂。
②能判断该反应在“图2”所在条件下是否已达化学平衡状态的依据是 。(双选)
| A.容器中压强不变 | B.体系的密度不随时间改变 |
| C.v正(H2)=2v逆(CH3OH) | D.CO与H2的物质的量的比不随时间改变 |
 CH3OH(g)的化学平衡常数K= 。
CH3OH(g)的化学平衡常数K= 。④请在“图3”中画出平衡时甲醇百分含量(纵坐标)随温度(横坐标)变化的曲线,要求画压强不同的2条曲线(在曲线上标出P1、P2,且P1<P2)。
(3)CaSO4是一种微溶物质,已知Ksp(CaSO4)=9.10×10-6。现将c mol·L-1 CaCl2溶液与2.00×10-2 mol·L-1 Na2SO4溶液等体积混合生成沉淀,则c的最小值是 (结果保留3位有效数字)。
(16分)
(1)CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(l) △H=—725.8kJ/mol (共3分,化学方程式1分,△H 2分。如果甲醇的系数不是1扣2分,状态符号不全扣1分,△H漏单位扣1分)
(2)①b(2分)②AC(2分,全对2分,选对1
个得1分,有错得0分。)
③ 12(3分,有单位且正确也给分)
④(3分,全对才得分,不标P1、P2不给分)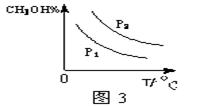
(3)1.82×10-3(3分,多写单位不扣分,有效数字错扣1分)
解析试题分析:(1)依题意,根据盖斯定律和燃烧热的定义,由①/2—②×2可得:CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(l) △H=—725.8kJ/mol;(2)①读图,曲线a、b表示活化能不同,说明b使用了催化剂,降低该反应的活化能;②正反应是气体物质的量增大的方向,未达平衡时容器中混合气体总的物质的量增大,因此压强增大,若压强不变,说明各组分物质的量不变,即达到平衡,故A正确;由于混合气体的密度等于混合气体的总质量除以密闭容器的容积,由于各组分都是气体,根据质量守恒定律推断混合气体的总质量始终不变,因此密度不变不能说明达到平衡,故B错误;用不同物质表示的正、逆反应速率之比等于化学方程式中的系数之比,说明达到平衡,故C正确;各组分的物质的量不随时间改变能说明达到平衡,但两反应物的物质的量之比不随时间改变,则不能说明达到平衡,故D错误;③由读图可推断该反应中各组分(起始、变化、平衡)浓度,则:
CO(g) + 2H2(g)  CH3OH(g)
CH3OH(g)
起始浓度/ mol?Lˉ1 1.00 2.00 0
变化浓度/ mol?Lˉ1 0.75 1.50 0.75
平衡浓度/ mol?Lˉ1 0.25 0.50 0.75
K=c(CH3OH)/[c(CO)?c2(H2))]=" 0.75/[" 0.25××0.502]=12
④正反应是气体体积减小的反应,根据化学反应自发进行的规律推断,逆反应能自发进行的原因是符合熵判据,正反应能自发的原因是符合焓判据,所以正反应是放热反应,其它条件不变时,升高温度平衡向逆反应方向移动,甲醇百分含量减小;增大压强平衡向正反应方向移动,甲醇百分含量增大;因此画图要点是:P1、P2时甲醇百分含量都随温度升高逐渐减小,P2时甲醇百分含量—温度曲线高于P1;
(3)两溶液混合导致相互稀释,根据稀释定律:c1?V1=c2?V2,则混合后氯化钙和硫酸钠溶液的浓度都要减半;因此钙离子浓度为c/2 mol·L-1,硫酸根离子浓度为1.00×10-2 mol·L-1,由于Ksp(CaSO4)=c(Ca2+)?c(SO42-),则c/2×1.00×10-2=9.10×10-6,即c=1.82×10-3;根据溶度积规则,只有Qc(CaSO4)> Ksp(CaSO4)时,才能形成硫酸钙的过饱和溶液,才有沉淀析出,则c最小值为1.82×10-3。
考点:考查化学反应原理,涉及盖斯定律和燃烧热、催化剂对化学反应的影响、化学平衡的判断依据、化学平衡常数、判断放热反应或吸热反应、画出温度和压强对平衡移动的影响图像、稀释公式及溶度积的计算。

(7分)(1)臭氧可用于净化空气、饮用水消毒、处理工业废物和作为漂白剂。
①臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。如:
6Ag(s)+O3(g)===3Ag2O(s);△H =" -235.8" kJ/mol;
己知:2 Ag2O(s)===4Ag(s)+O2(g);△H = +62.2kJ/mol;
则反应 2O3(g)= 3O2(g) 的△H = kJ/mol;
②科学家P.Tatapudi等人首先使用在酸性条件下电解水的方法制得臭氧。臭氧在阳极周围的水中产
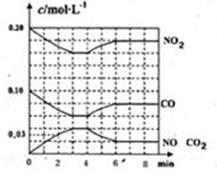
生,阴极附近的氧气则生成过氧化氢,阴极电极反应式为 。 (2)用活性炭还原法处理氮氧化物,有关反应为:C(s)+2NO(g) N2(g)+CO2(g) 某研究小组向某密闭的真空容器(假设容器体积不变,固体试样体积忽略不计)中加入NO和足量的活性炭,恒温(T1℃) 条件下反应,反应进行到不同时间测得各物质的浓度如下:
(2)用活性炭还原法处理氮氧化物,有关反应为:C(s)+2NO(g) N2(g)+CO2(g) 某研究小组向某密闭的真空容器(假设容器体积不变,固体试样体积忽略不计)中加入NO和足量的活性炭,恒温(T1℃) 条件下反应,反应进行到不同时间测得各物质的浓度如下: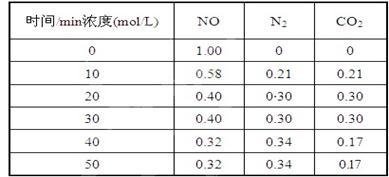
①在10 min~20 min的时间段内,以CO2表示的反应速率为 ;
②写出该反应的平衡常数的表达式K= ;
③下列各项能作为判断该反应达到平衡状态的是 (填序号字母);
| A.容器内压强保持不变 | B.2v正(NO)=v逆(N2) |
| C.容器内CO2的体积分数不变 | D.混合气体的密度保持不变 |
⑤一定温度下,随着NO的起始浓度增大,则NO的平衡转化率 (填“增大”、“不变”或“减小”)。
“神七”登天谱写了我国航天事业的新篇章。火箭升空需要高能的燃料,通常用肼(N2H4)作为燃料,N2O4做氧化剂。
(1)已知:N2(g) + 2O2(g) =2NO2(g) △H=+67.7 kJ·mol-1
N2H4(g) + O2(g) =N2(g) + 2H2O(g) △H=-534.0 kJ·mol-1
2NO2(g) N2O4(g) △H=-52.7 kJ·mol-1
N2O4(g) △H=-52.7 kJ·mol-1
试写出气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式: 。
(2)工业上可用次氯酸钠与过量的氨反应制备肼,该反应的化学方程式为: 。
(3)一定条件下,在2L密闭容器中起始投入2 mol NH3和4 mol O2发生反应:
4NH3(g)+5O2(g) 4NO(g)+6H2O(g) ΔH<0
4NO(g)+6H2O(g) ΔH<0
测得平衡时数据如下:
| 平衡时物质的量(mol) | n(NO) | n(H2O) |
| 温度T1 | 1.6 | 2.4 |
| 温度T2 | 1.2 | 1.8 |
①在温度T1下,若经过10min反应达到平衡,则10min内反应的平均速率
v(NH3)= 。
②温度T1和T2的大小关系是T1 T2(填“>”、 “<”或“=”)。
(4)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料。已知该反应的阳极反应为:
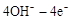 =O2↑+2H2O,则阴极反应为 。有人提出,可以设计反应2CO=2C+O2(△H>0)来消除CO的污染。请你判断上述反应是否能自发进行并说明理由 。
=O2↑+2H2O,则阴极反应为 。有人提出,可以设计反应2CO=2C+O2(△H>0)来消除CO的污染。请你判断上述反应是否能自发进行并说明理由 。(5)下图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH溶液为电解液。
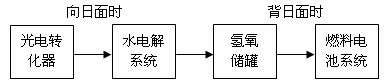
如果某段时间内氢氧储罐中共收集到33.6L气体(已折算成标准状况),则该段时间内水电解系统中转移电子的物质的量为 mol。
以下是一些物质的熔沸点数据(常压):
| | 钾 | 钠 | Na2CO3 | 金刚石 | 石墨 |
| 熔点(℃) | 63.65 | 97.8 | 851 | 3550 | 3850 |
| 沸点(℃) | 774 | 882.9 | 1850(分解产生CO2) | ---- | 4250 |
金属钠和CO2在常压、890℃发生如下反应:
4 Na(g)+ 3CO2(g)
 2 Na2CO3(l)+ C(s,金刚石) △H=-1080.9kJ/mol
2 Na2CO3(l)+ C(s,金刚石) △H=-1080.9kJ/mol(1)上述反应的平衡常数表达式为 ;若4v正(Na)=3v逆(CO2),反应是否达到平衡 (选填“是”或“否”)。
(2)若反应在10L密闭容器、常压下进行,温度由890℃升高到1680℃,若反应时间为10min, 金属钠的物质的量减少了0.20mol,则10min里CO2的平均反应速率为 。
(3)高压下有利于金刚石的制备,理由是 。
(4)由CO2(g)+4Na(g)=2Na2O(s)+C(s,金刚石) △H=-357.5kJ/mol;则Na2O固体与C(金刚石)反应得到Na(g)和液态Na2CO3(l)的热化学方程式 。
(5)下图开关K接M时,石墨作 极,电极反应式为 。K接N一段时间后测得有0.3mol电子转移,作出y随x变化的图象〖x—代表n(H2O)消耗,y—代表n[Al(OH)3],反应物足量,标明有关数据〗
在反应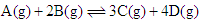 中,表示该反应速率最快的是( )
中,表示该反应速率最快的是( )
A.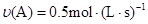 | B.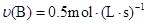 |
C.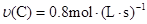 | D.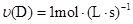 |
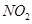 、
、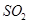 、CO等大气污染气体的测量及处理具有重要意义。
、CO等大气污染气体的测量及处理具有重要意义。 可使
可使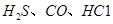 等氧化,常用于定量测定CO的含量。已知:
等氧化,常用于定量测定CO的含量。已知: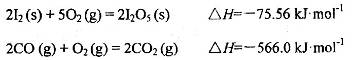
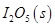 反应生成
反应生成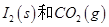 的热化学方程式:________________。
的热化学方程式:________________。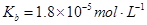

 ________2(填“>”“<”或“=”)
________2(填“>”“<”或“=”)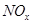 可用强碱溶液吸产生硝酸盐。在酸性条件下,FeSO4溶液能将
可用强碱溶液吸产生硝酸盐。在酸性条件下,FeSO4溶液能将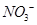 还原为NO,写出该过程中产生NO反应的离子方程式___________________________________。
还原为NO,写出该过程中产生NO反应的离子方程式___________________________________。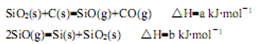
 Si(s)+3HCl(g)不同温度及不同n(H2)/n(SiHCl3)时,反应物X的平衡转化率关系如图;
Si(s)+3HCl(g)不同温度及不同n(H2)/n(SiHCl3)时,反应物X的平衡转化率关系如图;
 N2(g)+2CO2(g)的△H= 。
N2(g)+2CO2(g)的△H= 。