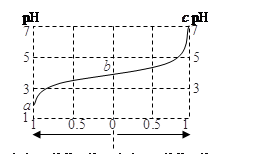题目内容
在25℃时,向50.00 mL未知浓度的CH3COOH溶液中逐滴加入0.5 mol·L-1的NaOH溶液。滴定过程中,溶液的pH与滴入NaOH溶液体积的关系如图所示,则下列说法中,正确的是
| A.该中和滴定过程,最宜用石蕊作指示剂 |
B.图中点②所示溶液中, |
| C.图中点①所示溶液中水的电离程度大于点③所示溶液中水的电离程度 |
D.滴定过程中的某点,会有 的关系存在 的关系存在 |
B
解析试题分析:A、石蕊颜色变化不明显,不能用作酸碱中和滴定的指示剂,错误;B、图中点②pH=7,根据溶液呈中性,可得c(H+)+c(Na+)=c(CH3COO?)+c(OH?),可得c(CH3COO?)=c(Na+),正确;C、图中点①pH为4,H+浓度为10-4mol?L?1,抑制了水的电离,点③pH=8,OH?浓度为10-6mol?L?1,抑制水的电离作用较弱,所以图中点①所示溶液中水的电离程度小于点③所示溶液中水的电离程度,错误;D、 违背了电荷守恒,错误。
违背了电荷守恒,错误。
考点:本题考查离子浓度比较、水的电离、指示剂选择。

练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案
相关题目
由一价离子组成的四种盐AC、BD、AD、BC均为0.1 mol/L溶液,在同温下,前两种溶液pH=7,第三种溶液pH>7,最后一种溶液pH<7, 则形成四种盐的酸和碱强弱比较正确的是
| | A | B | C | D |
| 碱 性 | AOH>BOH | AOH>BOH | AOH<BOH | AOH<BOH |
| 酸 性 | HC<HD | HC>HD | HC>HD | HC< HD |
已知某温度下CH3COOH和NH3?H2O 的电离常数相等,现向10mL浓度为0.1mol?L?1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中
| A.水的电离程度始终增大 |
| B.c(NH4+)/c(NH3?H2O)先增大再减小 |
| C.c(CH3COOH)与c(CH3COO?)之和始终保持不变 |
| D.当加入氨水的体积为10mL时,c(NH4+)=c(CH3COO?) |
由几种常见的盐混合组成的白色粉末,其中只可能含有Na+、K+、Al3+、CO32-、HCO3-、SO42-、NO2-中的若干种离子。某同学对该溶液进行如下实验: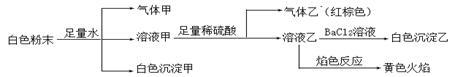
以下说法正确的是
| A.白色沉淀甲是Al(OH)3,气体甲是CO2,所以混合物一定含Al3+和HCO3- |
| B.气体乙一定是NO和NO2的混合气体 |
| C.白色沉淀乙是BaSO4,所以原混合物一定含有SO42- |
| D.白色粉末中一定含有Na+ 、Al3+ 、NO2- |
HF为一元弱酸,在0.1mol·L-1 NaF溶液中,离子浓度关系正确的是
| A.c(Na+)>c(F-)>c(H+)>c(OH-) | B.c(Na+)>c(OH-)>c(F-)>c(H+) |
| C.c(Na+) + c(OH-)=c(F-) + c(H+) | D.c(Na+) + c(H+)=c(F-) + c(OH-) |
25℃时,下列各溶液(均为0.1 mol·L-1)中,离子(或分子)的物质的量浓度关系正确的是
| A.氯化铵溶液中:c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
| B.碳酸钠溶液中:c(HCO3-)+c(CO32-)+c(H2CO3)=0.1 mol·L-1 |
| C.醋酸钠溶液中:c(OH-)>c(H+)+c(CH3COOH) |
| D.碳酸氢钠溶液中:c(Na+)-c(OH-)=c(HCO3-)+c(CO32-)-c(H+) |
相同体积的pH=3的强酸溶液和弱酸溶液分别跟足量的镁完全反应
| A.强酸溶液产生较多的氢气 | B.两者产生等量的氢气 |
| C.无法比较两者产生氢气的量 | D.弱酸溶液产生较多的氢气 |