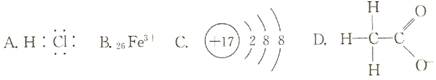题目内容
25℃时,由弱酸(HA)及其盐(NaA)组成的混合溶液,起始浓度均为1mol·L-1。下图为向该溶液中通入HCl气体或加入NaOH固体时,溶液pH随加入H+或OH-的物质的量而变化的曲线。下列说法中,正确的是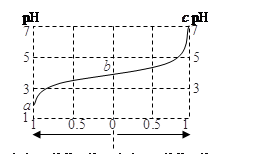
A.加NaOH,HA电离平衡常数增大
B.通入HCl,溶液中阴离子浓度之和减小
C.溶液中水的电离程度a>b>c
D.b点溶液中,c(HA)<c(A-)
D
解析试题分析:A、电离常数只受温度的影响,加NaOH,HA电离平衡常数不变,A不正确;B、通入HCl,增大氯离子浓度,因此通入HCl,溶液中阴离子浓度之和增大,B不正确;C、a、b溶液呈酸性,抑制水的电离,C呈中性,pH越小,酸性越强,水的电离程度越小,则a、b、c三点所表示的溶液中水的电离程度依次增大,故C不正确;D、b点溶液显酸性,说明HA的电离程度大于A-的水解程度,因此b点溶液中,c(HA)<c(A-),故D正确,答案选D。
考点:考查酸碱混合的定性判断和计算

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列说法正确的是
| A.镀锌铁板是利用了牺牲阳极的阴极保护法来达到防止腐蚀的目的 |
| B.在滴有酚酞的Na2CO3溶液中,加入BaCl2溶液后红色褪去,说明BaCl2溶液显酸性 |
| C.合成氨反应需使用催化剂,说明催化剂可以促进该平衡向生成氨的方向移动 |
D.汽车尾气的净化反应2NO+2CO 2CO2+N2△H<0,则该反应一定能自发进行 2CO2+N2△H<0,则该反应一定能自发进行 |
下列叙述正确的是
| A.0.1mol·L-1CH3COONa溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| B.NH4Cl溶液加水稀释后,恢复至原温度,pH和KW均增大 |
| C.pH=4的CH3COOH溶液和pH=4的NH4Cl溶液中,c(H+)不相等 |
| D.在NaHCO3溶液中:c(OH-)+c(CO32-)=c(H+)+c(H2CO3) |
在25℃时,向50.00 mL未知浓度的CH3COOH溶液中逐滴加入0.5 mol·L-1的NaOH溶液。滴定过程中,溶液的pH与滴入NaOH溶液体积的关系如图所示,则下列说法中,正确的是
| A.该中和滴定过程,最宜用石蕊作指示剂 |
B.图中点②所示溶液中, |
| C.图中点①所示溶液中水的电离程度大于点③所示溶液中水的电离程度 |
D.滴定过程中的某点,会有 的关系存在 的关系存在 |
下列叙述正确的是 ( )
| A.将过量CO2气体通入水玻璃中可制得硅酸和纯碱 |
B.标准状况下,2.24L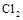 与过量稀NaOH溶液反应,转移电子0.1mol 与过量稀NaOH溶液反应,转移电子0.1mol |
| C.1L2mol·L-1明矾经水解可得到氢氧化铝胶体粒子数目为2×6.02×1023 |
| D.漂白粉溶于水能导电,故漂白粉是电解质 |
已知常温下AgCl的Ksp=1.8×10-10,AgI的Ksp=8.5×10-17。若向5mL含有KCl和KI各为0.01mol/L的混合溶液中加入8mL 0.01mol/L AgNO3溶液,此时溶液中所含溶质的离子浓度大小关系正确的是
| A.c(K+)>c(NO3-)>c(Cl-)>c(Ag+)>c(I-) |
| B.c(K+)>c(NO3-)>c(Ag+)>c(Cl-)>c(I-) |
| C.c(NO3-)>c(K+)>c(Ag+)>c(Cl-)>c(I-) |
| D.c(K+)>c(NO3-)>c(Ag+)=c(Cl-)+c(I-) |
在t℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知t℃时AgCl的Ksp=4×10-10,下列说法不正确的是 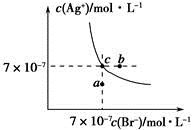
| A.在t℃时,AgBr的Ksp为4.9×10-13 |
| B.在AgBr饱和溶液中加入NaBr固体,可使溶液由c点到b点 |
| C.图中a点对应的是AgBr的不饱和溶液 |
D.在t℃时,AgCl(s)+Br-(aq)  AgBr(s)+Cl-(aq)平衡常数K≈816 AgBr(s)+Cl-(aq)平衡常数K≈816 |
 B. 混合液中:c(HA)+c(A-)=a mol·L-1
B. 混合液中:c(HA)+c(A-)=a mol·L-1