题目内容
13.某化学小组设计如图所示实验来验证有关氯气和二氧化硫的性质.(1)该实验小组的甲、乙两位同学利用如图1所示的装置验证氯气和二氧化硫混合后的漂白能力,请回答下列问题:
①指出在气体进入品红溶液之前,先将SO2和Cl2通过浓硫酸中的目的使SO2和Cl2混合均匀,通过观察气泡控制气体的流速;
②通气一段时间后,甲同学的实验过程中品红溶液几乎不褪色,原因是控制SO2和Cl2按物质的量之比1:1进气,二者发生反应,生成无漂白性的H2SO4和HCl,SO2+Cl2+2H2O=SO42-+2Cl-+4H+;
(2)乙同学在做实验时,观察到品红溶液颜色随时间的推移变得越来越浅,原因是通入的二氧化硫或者氯气一方有剩余.
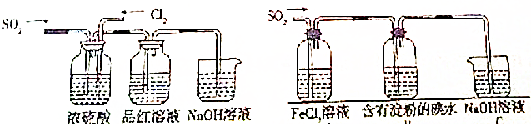
分析 (1)①浓硫酸和二氧化硫、氯气不反应,但氯气和二氧化硫在该装置中能充分混合,且通过观察气泡的速度控制气体流量,使二者按一定比列混合;
②氯气有强氧化性,二氧化硫有还原性,二者能按1:1发生氧化还原反应而使气体失去漂白性;
(2)如果SO2和Cl2的进气速度不相等,混合发生反应后其中一种气体有剩余,仍具有漂白性.
解答 解:(1)①浓硫酸和二氧化硫、氯气不反应,但氯气和二氧化硫在该装置中能充分混合,且通过观察气泡的速度控制气体流量,使二者按一定比列混合;
故答案为:使SO2和Cl2混合均匀,通过观察气泡控制气体的流速;
②氯气有强氧化性,二氧化硫有还原性,二者能按1:1发生氧化还原反应而使气体失去漂白性,离子反应方程式为SO2+Cl2+2H2O═4H++SO42-+2Cl-;
故答案为:控制SO2和Cl2按物质的量之比1:1进气,二者发生反应,生成无漂白性的H2SO4和HCl,SO2+Cl2+2H2O=SO42-+2Cl-+4H+;
(2)通气一段时间后,品红溶液颜色随时间推移变得越来越浅,说明有漂白性;如果SO2和Cl2的进气速度不相等,混合发生反应后其中一种气体有剩余,仍具有漂白性.
故答案为:通入的二氧化硫或者氯气一方有剩余.
点评 本题考查了次氯酸和二氧化硫的漂白性,难度不大,注意二氧化硫和氯气铵1:1的比例恰好完全反应,题目难度不大.

练习册系列答案
 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案
相关题目
3.下列关于乙醇的性质的说法中,不正确的是( )
| A. | 能与水以任意比互溶 | B. | 无色、无味的液体 | ||
| C. | 能使酸性KMnO4溶液褪色 | D. | 能与金属钠发生反应 |
1.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 使石蕊变红色的溶液:Mg2+、K+、SO42-、NO3- | |
| B. | 使pH试纸呈深蓝色的溶液:Na+、Ba2+、HCO3-、NO3- | |
| C. | 0.1 mol•L-1AgNO3 溶液:H+、K+、SO42-、Br- | |
| D. | 0.1 mol•L-1 FeCl3溶液:H+、Na+、I-、SO42- |
8.下列物质中不能与金属钠反应的是( )
| A. | 苯 | B. | 水 | C. | 氧气 | D. | 乙醇 |
18.下列叙述中,正确的是( )
| A. | 0.3 mol/L的Na2SO4溶液中含有Na+和SO42-的总物质的量为0.9 mol | |
| B. | 当1 L水吸收标准状况下的22.4 L氯化氢时所得盐酸的浓度是1 mol/L | |
| C. | 在K2SO4和NaCl的中性混合水溶液中,如果Na+和SO42-的物质的量相等,则K+和Cl-的物质的量浓度一定相同 | |
| D. | 10℃时,0.35 mol/L的KCl饱和溶液100 mL蒸发掉5 g水,恢复到10℃时,它的物质的量浓度仍为0.35 mol/L |
5.某芳香族化合物的分子式为C8H6O2,它的分子(除苯环外不含其他环)中不可能有( )
| A. | 一个醛基 | B. | 一个羧基 | C. | 两个羟基 | D. | 两个醛基 |
2.下列关于有机物的性质或应用说法不正确的是( )
| A. | 淀粉、纤维素、油脂、蛋白质都是高分子化合物,都能发生水解反应 | |
| B. | CH2Cl2只有一种结构说明甲烷分子是正四面体结构,而不是平面正方形结构 | |
| C. | 煤通过干馏可得到焦炭、煤焦油、焦炉气、粗氨水等 | |
| D. | 油脂皂化反应的产物是高级脂肪酸盐和甘油 |
3.下列说法不正确的是( )
| A. | 原子种类由质子数和中子数共同决定 | |
| B. | 质子数相同的粒子一定属于同种元素 | |
| C. | 元素的性质主要由元素原子的最外层电子数决定 | |
| D. | 同位素的物理性质有差别而化学性质几乎完全相同 |
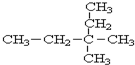 3,3-二甲基戊烷.
3,3-二甲基戊烷. .再将反应后的混合物转移到分液漏斗中,振荡、静置,然后分液.从分液漏斗放出下层液体,加入适量盐酸,再将其分成两份:向一份溶液中加入三氯化铁溶液,出现的现象是溶液呈紫色;向另一份溶液中加入浓溴水,反应的化学方程式为
.再将反应后的混合物转移到分液漏斗中,振荡、静置,然后分液.从分液漏斗放出下层液体,加入适量盐酸,再将其分成两份:向一份溶液中加入三氯化铁溶液,出现的现象是溶液呈紫色;向另一份溶液中加入浓溴水,反应的化学方程式为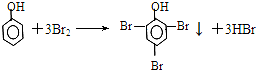 .从分液漏斗上口倒出的液体是苯.
.从分液漏斗上口倒出的液体是苯.