题目内容
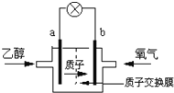
【题目】废旧硬质合金刀具中含碳化钨(WC)、金属钴(Co)及少量杂质铁,利用电解法回收WC和制备Co2O3的工艺流程简图如下:
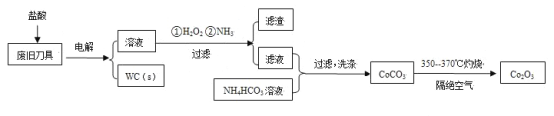
已知:在上述流程中,各种金属离子形成氢氧化物沉淀的pH范围如下:
金属离子 | Fe3+ | Fe2+ | Co2+ |
开始沉淀的pH | 1.9 | 7.0 | 6.5 |
沉淀完全的pH | 3.2 | 9.0 | 9.4 |
回答下列问题:
(1)以废旧刀具作阳极,不锈钢作阴极,盐酸为电解质溶液。电解时阳极的电极反应有:Co-2e-=Co2+和______。
(2)通入氨气的目的是调节溶液的pH,除去铁元素。由表中的数据可知,理论上可选择的pH的范围是_______。
(3)生成CoCO3的离子方程式是________。
(4)实验测得NH4HCO3溶液显碱性。制备CoCO3时,不能将滤液加入NH4HCO3溶液中,原因是_______。
(5)已知:Ksp(CoCO3)=1.4×10-13,Ksp(CoC2O4)=6.3×10-8。若仅从沉淀转化角度考虑,在0.01mol/L Na2C2O4溶液中加入CoCO3固体能否转化为CoC2O4沉淀?通过计算说明:_________。
(6)洗涤CoCO3不充分对最终产品纯度并无影响,但在焙烧时会造成环境污染,主要原因是____。
(7)CoCO3生成Co2O3的化学方程式是_________。
【答案】Fe -2e-=Fe2+ 3.2≤pH<6.5 Co2+ +2HCO3-=CoCO3↓+CO2↑+H2O 将滤液加入显碱性的NH4HCO3溶液中会生成Co(OH)2杂质 ![]()
 灼烧时,CoCO3中残留的NH4Cl分解产生NH3和HCl 2CoCO3
灼烧时,CoCO3中残留的NH4Cl分解产生NH3和HCl 2CoCO3![]() Co2O3+CO2↑+CO↑
Co2O3+CO2↑+CO↑
【解析】
由题给工艺流程知,以盐酸为电解质溶液,以废旧刀具作阳极,不锈钢作阴极,进行电解,生成WC,溶液中含有亚铁离子和Co2+,加入双氧水,将亚铁离子氧化为铁离子,通入氨气,调节pH在3.2到5.8之间,将铁离子转化为氢氧化铁沉淀过滤除去,滤液中含有Co2+,加入碳酸氢铵溶液生成碳酸钴,焙烧生成Co2O3,据此分析作答。
(l)依据电解原理可知,电解时废旧刀具作阳极,除了Co还有活泼金属铁也会失电子发生氧化反应;
(2)通入氨气的目的是调节溶液的pH,为了使铁元素完全沉淀,同时不让钴元素沉淀下来,根据表格数据作答;
(3)将NH4HCO3溶液缓慢加入到盛有滤液的反应容器中生成CoCO3;
(4)NH4HCO3溶液显碱性,据此分析作答;
(5)依据Ksp(CoCO3)=1.4×10-13计算出理论上开始沉淀时Co2+的物质的量浓度,再结合溶液中的C2O42-的物质的量浓度,根据离子积与Ksp(CoC2O4)的大小关系进行比较,得出结论。
(6)实验中获得的若洗涤不充分会含有氯化铵杂质,在焙烧时氯化铵受热易分解;
(7)依据氧化还原反应的规律可知,CoCO3隔绝空气灼烧生成Co2O3的同时,C元素化合价会降低,据此分析作答。
(1)电解时废旧刀具作阳极,不锈钢作阴极,盐酸的作用是作电解质溶液,依据阳极活泼金属放电的规律可知,除了Co失电子以外还有Fe也会失电子发生氧化反应,其电极反应式为:Fe -2e- = Fe2+;
故答案为:Fe -2e- = Fe2+;
(2)通入氨气的目的是调节溶液的pH,除去铁元素。由表中的数据可知,理论上可选择pH最大范围是3.2pH<6.5;
故答案为:3.2pH<6.5;
(3)将NH4HCO3溶液缓慢加入到盛有滤液的反应容器中,生成CoCO3的离子方程式为:Co2+ +2HCO3-=CoCO3↓+CO2↑+H2O;
故答案为:Co2+ +2HCO3-=CoCO3↓+CO2↑+H2O;
(4) 根据题意可知,NH4HCO3溶液显碱性,则若将滤液加入该溶液中会反应生成Co(OH)2杂质,
故答案为:将滤液加入显碱性的NH4HCO3溶液中会生成Co(OH)2杂质;
(5)![]()
 ,
,
故答案为:![]()
 ;
;
(6)分析可知实验中获得的若洗涤不充分会含有氯化铵杂质,在焙烧时氯化铵分解会产生污染性气体HCl和NH3;
故答案为:灼烧时,CoCO3中残留的NH4Cl分解产生NH3和HCl;
(7)CoCO3生成Co2O3的同时,还会有二氧化碳与一氧化碳生成,其化学方程式为:2CoCO3![]() Co2O3+CO2↑+CO↑,
Co2O3+CO2↑+CO↑,
故答案为:2CoCO3![]() Co2O3+CO2↑+CO↑。
Co2O3+CO2↑+CO↑。

 名题金卷系列答案
名题金卷系列答案