题目内容
【题目】已知:四甲基氢氧化铵[(CH3)4NOH ]是强碱,甲胺 (CH3NH2H2O)为弱碱。常温下,在体积均为20 mL、浓度均为0.1 mol/L的四甲基氢氧化铵溶液和甲胺溶液中,分别滴加浓度为0.1 mol/L的盐酸,溶液的导电率与盐酸体积的关系如图所示。下列说法正确的是

A. pH的相对大小: c>d
B. 在b、c、e三点中,水的电离程度最大的点是e
C. b 点溶液:c(H+)+c(CH3NH3+) = c(OH-)
D. c 点溶液:c(Cl-)>c(CH3NH3+) >c(H+) >c(OH-)
【答案】D
【解析】
A.当滴加20mL盐酸时,恰好完全反应,一个是强酸强碱盐溶液,溶液呈中性;一个是强酸弱碱盐溶液,溶液水解呈酸性,再比较pH大小;
B.酸碱会抑制水的电离,能水解的盐则会促进水的电离,据此分析;
C.该选项中的等式阴阳离子分别再等号两边,所以可以写出电荷守恒分析是否正确;
D.当滴加20mL盐酸时,溶质为强酸弱碱盐CH3NH3Cl,水解使溶液显酸性,且水解程度是很弱的,据此分析离子大小。
A.当滴加20mL盐酸时,恰好完全反应,四甲基氢氧化铵[(CH3)4NOH ]是强碱,此时溶液中溶质为强酸强碱盐,溶液呈中性;甲胺 (CH3NH2H2O)为弱碱,此时溶液中溶质为强酸弱碱盐,溶液呈酸性,pH相对大小:c<d,故A错误;
B.体积为20mL、浓度为0.1mol·L-1的甲胺溶液,滴加浓度为0.1mol·L-1的盐酸,当滴加20mL盐酸时,恰好完全反应,此时溶液中溶质为强酸弱碱盐,促进水电离,此时水电离程度最大,即b、c、e三点中c点水的电离程度最大,故B错误;
C.根据电荷守恒,b 点溶液:c(H+)+c(CH3NH3+) = c(OH-)+ c(Cl-),故C错误;
D.当滴加20mL盐酸时,恰好完全反应,此时溶液中溶质为强酸弱碱盐CH3NH3Cl,少量CH3NH3+水解使溶液显酸性,所以溶液中的离子浓度大小:c(Cl-)>c(CH3NH3+) >c(H+) >c(OH-),故D正确;
答案:D。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】废旧硬质合金刀具中含碳化钨(WC)、金属钴(Co)及少量杂质铁,利用电解法回收WC和制备Co2O3的工艺流程简图如下:
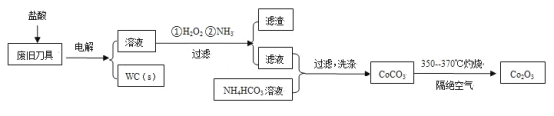
已知:在上述流程中,各种金属离子形成氢氧化物沉淀的pH范围如下:
金属离子 | Fe3+ | Fe2+ | Co2+ |
开始沉淀的pH | 1.9 | 7.0 | 6.5 |
沉淀完全的pH | 3.2 | 9.0 | 9.4 |
回答下列问题:
(1)以废旧刀具作阳极,不锈钢作阴极,盐酸为电解质溶液。电解时阳极的电极反应有:Co-2e-=Co2+和______。
(2)通入氨气的目的是调节溶液的pH,除去铁元素。由表中的数据可知,理论上可选择的pH的范围是_______。
(3)生成CoCO3的离子方程式是________。
(4)实验测得NH4HCO3溶液显碱性。制备CoCO3时,不能将滤液加入NH4HCO3溶液中,原因是_______。
(5)已知:Ksp(CoCO3)=1.4×10-13,Ksp(CoC2O4)=6.3×10-8。若仅从沉淀转化角度考虑,在0.01mol/L Na2C2O4溶液中加入CoCO3固体能否转化为CoC2O4沉淀?通过计算说明:_________。
(6)洗涤CoCO3不充分对最终产品纯度并无影响,但在焙烧时会造成环境污染,主要原因是____。
(7)CoCO3生成Co2O3的化学方程式是_________。




