题目内容
【题目】材料是人类文明进步的阶梯,第ⅢA、ⅣA、VA及Ⅷ族元素是组成特殊材料的重要元素。
回答下列问题:
(1)基态B核外电子占据的最高能级的电子云轮廓图形状为________。与硼处于同周期且相邻的两种元素和硼的第一电离能由大到小的顺序为______。
(2)某元素位于第四周期Ⅷ族,其基态原子的未成对电子数与基态氮原子的未成对电子数相同,则其基态原子的价层电子排布式为_____。
(3)经测定发现,N2O5固体由NO2+和NO3-两种离子组成,该固体中N原子杂化类型有__。
(4)MgCO3的热分解温度_____(填“高于”或“低于”)CaCO3的原因是________。
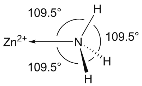
(5)NH3分子在独立存在时H-N-H键角为107°。如图是[Zn(NH3)6]2+离子的部分结构以及H-N-H键角的测量值。解释NH3形成如图配合物后H-N-H键角变大的原因:_________。
(6)某种金属锂的硼氢化物是优质固体电解质,并具有高储氢密度。阳离子为Li+,每个阴离子是由12个硼原子和12个氢原子所构成的原子团。阴离子在晶胞中位置如图所示,其堆积方式为_____,Li+占据阴离子组成的所有正四面体中心,该化合物的化学式为_____(用最简整数比表示)。假设晶胞边长为anm,NA代表阿伏伽德罗常数的值,则该晶胞的密度为_____g/cm3。

【答案】哑铃形 C>Be>B 3d74s2 sp、sp2 低于 r(Mg2+) < r(Ca2+),晶格能:MgO大于CaO,故MgCO3更易分解为MgO NH3分子中N原子的孤电子对进入Zn2+的空轨道形成配位键后,原孤电子对与成键电子对间的排斥作用变为成键电子对间的排斥,排斥作用减弱 面心立方最密堆积 LiB6H6 ![]()
【解析】
(1)基态B核外电子占据的最高能级为2p;与硼处于同周期且相邻的两种元素为C与Be,结合Be的最高能级2s上电子为全充满结构,第一电离能最大分析作答;
(2)第四周期Ⅷ族元素分别是铁、钴和镍,根据价层电子排布式分析作答;
(3)依据价层电子对互斥理论与杂化轨道理论结合判断杂化类型;
(4)依据MgO与CaO的晶格能大小来判断产物的稳定性,据此分析分解温度;
(5)依据孤电子对对成键键角的排斥力大于成键电子对键角的排斥力作答;
(6)依据金属晶体中金属原子在空间上的堆积方式分析判断模型;利用均摊法计算晶胞内原子的个数,再结合晶体的密度 = 晶胞的密度= ![]() 求算。
求算。
(1)基态B核外电子占据的最高能级2p,电子云轮廓图形状为哑铃形,同周期元素中,第一电离能从左到右呈增大趋势,因Be的价层电子排布式为2s2,位于IIA族,第一电离能比B的第一电离能大,则第一电离能比较:C>Be>B,
故答案为:哑铃形;C>Be>B;
(2)因基态氮原子的价层电子排布式为2s22p3,未成对电子数为3,而第四周期Ⅷ族Co的基态原子的价层电子排布式为3d74s2,未成对电子数也为3,符合题意,
故答案为:3d74s2;
(3)根据价层电子对数计算公式得,NO2+的价层电子数有2+![]() =2,故杂化轨道类型为sp,NO3-的价层电子数有3+
=2,故杂化轨道类型为sp,NO3-的价层电子数有3+![]() =3,故杂化轨道类型为sp2,
=3,故杂化轨道类型为sp2,
故答案为:sp、sp2;
(4)产物越稳定,碳酸盐热分解温度越低,因r(Mg2+) < r(Ca2+),晶格能:MgO大于CaO,故MgCO3更易分解为MgO,故MgCO3的热分解温度低于CaCO3,
故答案为:低于;因r(Mg2+) < r(Ca2+),晶格能:MgO大于CaO,故MgCO3更易分解为MgO;
(5)NH3分子中N原子的孤电子对进入Zn2+的空轨道形成配位键后,原孤电子对与成键电子对间的排斥作用变为成键电子对间的排斥,排斥作用减弱,导致形成配合物后H-N-H键角变大,
故答案为:NH3分子中N原子的孤电子对进入Zn2+的空轨道形成配位键后,原孤电子对与成键电子对间的排斥作用变为成键电子对间的排斥,排斥作用减弱;
(6)根据阴离子在晶胞中位置图,阴离子在晶胞顶点和面心,所以堆积方式为面心立方堆积;根据“均摊法”,阴离子数![]() ,Li+占据阴离子组成的所有正四面体中心,晶胞中共8个锂离子,故该化合物的化学式(最简式)为LiB6H6,晶体的密度 = 晶胞的密度=
,Li+占据阴离子组成的所有正四面体中心,晶胞中共8个锂离子,故该化合物的化学式(最简式)为LiB6H6,晶体的密度 = 晶胞的密度= ![]() =
=![]()
,
故答案为:面心立方最密堆积;LiB6H6;![]() 。
。

【题目】废旧硬质合金刀具中含碳化钨(WC)、金属钴(Co)及少量杂质铁,利用电解法回收WC和制备Co2O3的工艺流程简图如下:
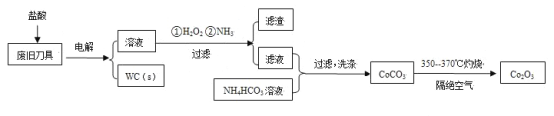
已知:在上述流程中,各种金属离子形成氢氧化物沉淀的pH范围如下:
金属离子 | Fe3+ | Fe2+ | Co2+ |
开始沉淀的pH | 1.9 | 7.0 | 6.5 |
沉淀完全的pH | 3.2 | 9.0 | 9.4 |
回答下列问题:
(1)以废旧刀具作阳极,不锈钢作阴极,盐酸为电解质溶液。电解时阳极的电极反应有:Co-2e-=Co2+和______。
(2)通入氨气的目的是调节溶液的pH,除去铁元素。由表中的数据可知,理论上可选择的pH的范围是_______。
(3)生成CoCO3的离子方程式是________。
(4)实验测得NH4HCO3溶液显碱性。制备CoCO3时,不能将滤液加入NH4HCO3溶液中,原因是_______。
(5)已知:Ksp(CoCO3)=1.4×10-13,Ksp(CoC2O4)=6.3×10-8。若仅从沉淀转化角度考虑,在0.01mol/L Na2C2O4溶液中加入CoCO3固体能否转化为CoC2O4沉淀?通过计算说明:_________。
(6)洗涤CoCO3不充分对最终产品纯度并无影响,但在焙烧时会造成环境污染,主要原因是____。
(7)CoCO3生成Co2O3的化学方程式是_________。