题目内容
【题目】已知HCN、CN在溶液中存在下列平衡,对应的平衡常数分别为K1和K2.①HCNH++CN△H1>0 K1 ②CN+H2OHCN+OH△H2>0 K2,常温下(K1=6.2×1010),将等体积、等物质的量浓度的HCN和NaCN溶液混合,下列叙述不正确的是( )
A. K2≈1.6×103 B. 2c(Na+)=c(HCN)+c(CN-)
C. 混合溶液的pH>7 D. 对混合溶液升温, K1增大、K2增大
【答案】A
【解析】
A. K1×K2= Kw,所以K2= ![]() ,故错误;
,故错误;
B. 将等体积、等物质的量浓度的HCN和NaCN溶液混合,根据溶液中的存在的物料守恒分析,有2c(Na+)=c(HCN)+c(CN-),故正确;
C. K1<K2,所以HCN的电离程度小于NaCN的水解程度,混合溶液呈碱性,则混合溶液的pH>7,故正确;
D. 对混合溶液升温,促进电离和水解,所以 K1增大、K2增大,故正确。
故选A。

 百年学典课时学练测系列答案
百年学典课时学练测系列答案【题目】废旧硬质合金刀具中含碳化钨(WC)、金属钴(Co)及少量杂质铁,利用电解法回收WC和制备Co2O3的工艺流程简图如下:
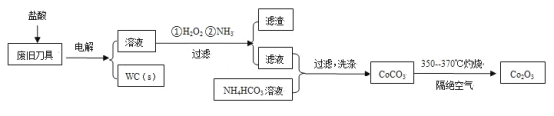
已知:在上述流程中,各种金属离子形成氢氧化物沉淀的pH范围如下:
金属离子 | Fe3+ | Fe2+ | Co2+ |
开始沉淀的pH | 1.9 | 7.0 | 6.5 |
沉淀完全的pH | 3.2 | 9.0 | 9.4 |
回答下列问题:
(1)以废旧刀具作阳极,不锈钢作阴极,盐酸为电解质溶液。电解时阳极的电极反应有:Co-2e-=Co2+和______。
(2)通入氨气的目的是调节溶液的pH,除去铁元素。由表中的数据可知,理论上可选择的pH的范围是_______。
(3)生成CoCO3的离子方程式是________。
(4)实验测得NH4HCO3溶液显碱性。制备CoCO3时,不能将滤液加入NH4HCO3溶液中,原因是_______。
(5)已知:Ksp(CoCO3)=1.4×10-13,Ksp(CoC2O4)=6.3×10-8。若仅从沉淀转化角度考虑,在0.01mol/L Na2C2O4溶液中加入CoCO3固体能否转化为CoC2O4沉淀?通过计算说明:_________。
(6)洗涤CoCO3不充分对最终产品纯度并无影响,但在焙烧时会造成环境污染,主要原因是____。
(7)CoCO3生成Co2O3的化学方程式是_________。


