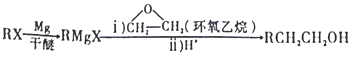题目内容
【题目】(1)2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200°C左右时供电,电池示意如图所示:
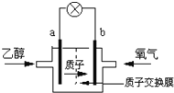
①____极(填a或b)为电池的正极,电池工作时电子的流向为_______(填a→b或b→a)
②写出该电池负极的电极反应式________________________________________
(2)图中X为电源,Y为浸透饱和食盐水和酚酞试液的滤纸,滤纸中央滴有一滴KMnO4溶液,通电后Y中央的紫红色斑向d端扩散。

①Y中总反应的化学方程式为_____________________,滤纸上c点附近会变________色。
②电解一段时间后,Z产生280 mL的气体(标准状况下),此时溶液的体积为500 mL,假设溶液中还有AgNO3存在,则Z中溶液的pH是________,需加入________g的________可使溶液复原。
【答案】b a→b C2H5OH-12e-+3H2O=12H++2CO2↑ 2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑ 红 1 5.8 Ag2O
2NaOH+H2↑+Cl2↑ 红 1 5.8 Ag2O
【解析】
(1)在燃料电池中,燃料在负极发生失电子的反应,电流在电路中从正极流向负极;
(2)紫红色斑即MnO4-向d端扩散,根据阴离子向阳极移动的原理,可知d端为阳极,即b为正极,a为负极,c为阴极。
(1)NaCl溶液中H+放电,产生OH-,c点附近会变红色。(2)电解AgNO3溶液时,Pt为阳极,溶液中的OH-放电:4OH--4e-=O2↑+2H2O,当有280 mL即0.012 5 mol的气体生成时,转移0.05 mol的电子,溶液中产生n(H+)=0.05 mol,即pH=1。
Ag为阴极,溶液中的Ag+得电子,生成银0.05 mol。脱离体系的是银元素和氧元素,且n(Ag)∶n(O)=2∶1,所以可以加入0.025 mol 的Ag2O或Ag2CO3。
(1)①燃料电池中,燃料乙醇在负极发生失电子的反应,氧气是在正极上发生得电子的反应,电流在电路中从正极流向负极,根据质子移动方向,可以知道b是正极,a是负极,故答案为:b;b→a;
②该电池负极的电极反应式为:C2H5OH+3H2O-12e-=2CO2+12H+;
(2)紫红色斑即MnO4-向d端扩散,根据阴离子向阳极移动的原理,可知d端为阳极,即b为正极,a为负极,c为阴极。
(1)Y中总反应的化学方程式为:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑,NaCl溶液中H+放电,产生OH-,c点附近会变红色。
2NaOH+H2↑+Cl2↑,NaCl溶液中H+放电,产生OH-,c点附近会变红色。
(2)电解AgNO3溶液时,Pt为阳极,溶液中的OH-放电:4OH--4e-=O2↑+2H2O,当有280 mL即0.012 5 mol的气体生成时,转移0.05 mol的电子,溶液中产生n(H+)=0.05 mol,c(H+)=0.05 mol/0.5L= 0.1 mol·L-1,即pH=1。
Ag为阴极,溶液中的Ag+得电子,生成银0.05 mol。脱离体系的是银元素和氧元素,且n(Ag)∶n(O)=2∶1,所以可以加入0.025 mol 的Ag2O或Ag2CO3。Ag2O质量为0.025mol×(108×2+16)g·mol-1=5.8g或Ag2CO3质量为0.025mol×(108×2+60)g·mol-1=6.9g。

【题目】废旧硬质合金刀具中含碳化钨(WC)、金属钴(Co)及少量杂质铁,利用电解法回收WC和制备Co2O3的工艺流程简图如下:
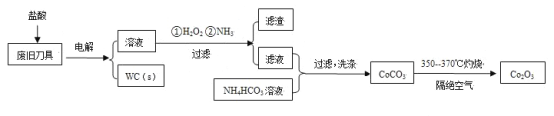
已知:在上述流程中,各种金属离子形成氢氧化物沉淀的pH范围如下:
金属离子 | Fe3+ | Fe2+ | Co2+ |
开始沉淀的pH | 1.9 | 7.0 | 6.5 |
沉淀完全的pH | 3.2 | 9.0 | 9.4 |
回答下列问题:
(1)以废旧刀具作阳极,不锈钢作阴极,盐酸为电解质溶液。电解时阳极的电极反应有:Co-2e-=Co2+和______。
(2)通入氨气的目的是调节溶液的pH,除去铁元素。由表中的数据可知,理论上可选择的pH的范围是_______。
(3)生成CoCO3的离子方程式是________。
(4)实验测得NH4HCO3溶液显碱性。制备CoCO3时,不能将滤液加入NH4HCO3溶液中,原因是_______。
(5)已知:Ksp(CoCO3)=1.4×10-13,Ksp(CoC2O4)=6.3×10-8。若仅从沉淀转化角度考虑,在0.01mol/L Na2C2O4溶液中加入CoCO3固体能否转化为CoC2O4沉淀?通过计算说明:_________。
(6)洗涤CoCO3不充分对最终产品纯度并无影响,但在焙烧时会造成环境污染,主要原因是____。
(7)CoCO3生成Co2O3的化学方程式是_________。