题目内容
已知某可逆反应:
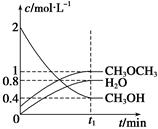
mA(g) + nB(g) pC(g) ?H=" Q" kJ·mol-1,在密闭容器中进行,右图表示在不同时间t、温度T和压强P与生成物C的百分含量的关系曲线,下列判断正确的是
pC(g) ?H=" Q" kJ·mol-1,在密闭容器中进行,右图表示在不同时间t、温度T和压强P与生成物C的百分含量的关系曲线,下列判断正确的是

mA(g) + nB(g)
 pC(g) ?H=" Q" kJ·mol-1,在密闭容器中进行,右图表示在不同时间t、温度T和压强P与生成物C的百分含量的关系曲线,下列判断正确的是
pC(g) ?H=" Q" kJ·mol-1,在密闭容器中进行,右图表示在不同时间t、温度T和压强P与生成物C的百分含量的关系曲线,下列判断正确的是
| A.T1 <T2 P1>P2 m+n<P Q<0 | B.T1>T2 P1<P2 m+n>P Q>0 |
| C.T1<T2 P1<P2 m+n<P Q>0 | D.T1>T2 P1<P2 m+n>P Q<0 |
C
试题分析:由图可以看出,温度T1 <T2,因为温度高,反应速率大,表现在图上是斜率大,故BD不正确,同理可以看出P1<P2,故A错误,排除可以选择答案为C。比较
 和
和 可以看出,温度高,C的百分含量小,所以该反应为吸热反应,故Q>0。
可以看出,温度高,C的百分含量小,所以该反应为吸热反应,故Q>0。点评:本题考查了化学平衡的移动,结合图像考查,是高考考查的热点,本题信息量大,有一定的难度。

练习册系列答案
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案
相关题目
 2SO3(g)。达平衡时容器中SO3的物质的量浓度为0.4mol/L,还剩余氧气3.0mol。
2SO3(g)。达平衡时容器中SO3的物质的量浓度为0.4mol/L,还剩余氧气3.0mol。 C (g) + D(g),能说明该反应达到化学平衡状态的是
C (g) + D(g),能说明该反应达到化学平衡状态的是
 zC(g),达到平衡后测得A的浓度为0.20mol/L。在恒温下增大压强使容器容积缩小为原来的一半,再次达到平衡时,测得A的浓度为0.35mol/L。下列说法不正确的是( )
zC(g),达到平衡后测得A的浓度为0.20mol/L。在恒温下增大压强使容器容积缩小为原来的一半,再次达到平衡时,测得A的浓度为0.35mol/L。下列说法不正确的是( )
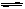 2NO2(g);△H=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如右图所示。下列说法正确的是( )
2NO2(g);△H=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如右图所示。下列说法正确的是( )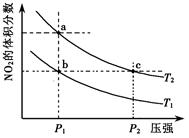
 2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040mol·L-1。计算该条件下反应的平衡常数K和SO2的平衡转化率 、 。
2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040mol·L-1。计算该条件下反应的平衡常数K和SO2的平衡转化率 、 。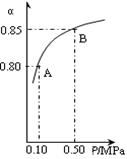
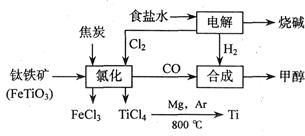
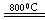 2MgCl4+Ti在Ar气氛中进行的理由是____________________。
2MgCl4+Ti在Ar气氛中进行的理由是____________________。 CH3OCH3(g)+H2O(g) ΔH=" -23.5" kJ/mol
CH3OCH3(g)+H2O(g) ΔH=" -23.5" kJ/mol