题目内容
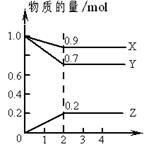
在某一容积为2 L的密闭容器中,A、B、C、D四种气体物质的量(n)随时间(t)的变化曲线如图所示:
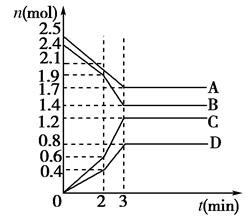
回答下列问题:
(1)该反应的化学方程式为___________________________________________;
(2)反应开始到2 min,用D的浓度变化表示的化学反应速率为___ _____;
(3)在2 min时,图象发生改变的原因可能是_______________________(用字母表示)
A. 升高温度 B.加入稀有气体,增大压强
C. 减少A的物质的量 D.加入催化剂
(4)下列叙述能说明上述反应达到平衡状态的是
A.混合气体的总质量不再变化 B.混合气体压强不再变化
C.v正(B)︰v逆(C)=5︰6 D.消耗1mol A的同时生成1mol D

回答下列问题:
(1)该反应的化学方程式为___________________________________________;
(2)反应开始到2 min,用D的浓度变化表示的化学反应速率为___ _____;
(3)在2 min时,图象发生改变的原因可能是_______________________(用字母表示)
A. 升高温度 B.加入稀有气体,增大压强
C. 减少A的物质的量 D.加入催化剂
(4)下列叙述能说明上述反应达到平衡状态的是
A.混合气体的总质量不再变化 B.混合气体压强不再变化
C.v正(B)︰v逆(C)=5︰6 D.消耗1mol A的同时生成1mol D
(8分)(1)4A(g)+5B(g) 6C(g)+4D(g);
6C(g)+4D(g);
(2)0.1mol·L-1·min-1 (3)AD (4)BC
 6C(g)+4D(g);
6C(g)+4D(g);(2)0.1mol·L-1·min-1 (3)AD (4)BC
试题分析:(1)根据图像可知,反应进行到3min时,ABCD的物质的量均不再发生变化,所以反应达到平衡状态,此时AB的物质的量分别减少了0.8mol、1.0mol,CD的物质的量增加了1.2mol和0.8mol,则根据变化量之比是相应的化学计量数之比可知,该反应的化学方程式为
4A(g)+5B(g)
 6C(g)+4D(g)。
6C(g)+4D(g)。(2)反应开始到2 min,用D的浓度变化表示的化学反应速率为
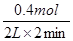 =0.1mol·L-1·min-1。
=0.1mol·L-1·min-1。(3)根据图像可知,在2 min时,图象中曲线的效率变大,则反应速率加快,所以改变的条件应该是升高温度或加入催化剂,AD正确。BC中反应速率降低,答案选AD。
(4)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。根据质量守恒定律可知,A不正确;该反应是体积增大的可逆反应,则压强也是增大的,所以当压强不再发生变化时,可以说明,B正确;C中反应速率的方向相反,且能满足速率之比是相应的化学计量数之比,正确。D中反应速率的方向相同,速率之比是相应的化学计量数之比,因此D中的关系始终是成立,不正确,因此答案选BC。
点评:该题是高考中的常见题型,属于中等难度的试题,试题贴近高考,基础性强,在注重对学生基础知识巩固和训练的同时,侧重对学生能力的培养和方法的指导。该题的关键是利用好反应速率之比是相应的化学计量数之比,然后结合题意和图像以及方程式灵活运用即可。

练习册系列答案
相关题目
 2C(g) △H=-QkJ·mol-1 (Q>0)在一个密闭容
2C(g) △H=-QkJ·mol-1 (Q>0)在一个密闭容 2NH3(g) ΔH<0。反应中NH3的物质的量浓度的变化情况如图所示。反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为
2NH3(g) ΔH<0。反应中NH3的物质的量浓度的变化情况如图所示。反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为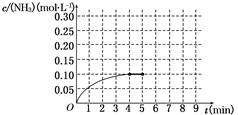
 3C(气),一定条件下,在一密闭、恒容的容器中,使一定量A和B气体反应,下列叙述能用来判断达到平衡状态的是:
3C(气),一定条件下,在一密闭、恒容的容器中,使一定量A和B气体反应,下列叙述能用来判断达到平衡状态的是:  2NO2(正反应是放热反应)反应中NO的转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是 ( )
2NO2(正反应是放热反应)反应中NO的转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是 ( )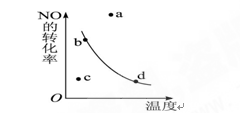
 pC(g) ?H=" Q" kJ·mol-1,在密闭容器中进行,右图表示在不同时间t、温度T和压强P与生成物C的百分含量的关系曲线,下列判断正确的是
pC(g) ?H=" Q" kJ·mol-1,在密闭容器中进行,右图表示在不同时间t、温度T和压强P与生成物C的百分含量的关系曲线,下列判断正确的是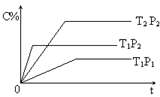
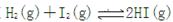 达到平衡状态时的标志是
达到平衡状态时的标志是