题目内容
在密闭容器中发生如下反应:xA(g)+yB(g)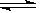 zC(g),达到平衡后测得A的浓度为0.20mol/L。在恒温下增大压强使容器容积缩小为原来的一半,再次达到平衡时,测得A的浓度为0.35mol/L。下列说法不正确的是( )
zC(g),达到平衡后测得A的浓度为0.20mol/L。在恒温下增大压强使容器容积缩小为原来的一半,再次达到平衡时,测得A的浓度为0.35mol/L。下列说法不正确的是( )
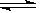 zC(g),达到平衡后测得A的浓度为0.20mol/L。在恒温下增大压强使容器容积缩小为原来的一半,再次达到平衡时,测得A的浓度为0.35mol/L。下列说法不正确的是( )
zC(g),达到平衡后测得A的浓度为0.20mol/L。在恒温下增大压强使容器容积缩小为原来的一半,再次达到平衡时,测得A的浓度为0.35mol/L。下列说法不正确的是( )| A.x+y﹥z | B.平衡向右移动 | C.B的转化率提高 | D.C的体积分数降低 |
D
试题分析:在恒温下增大压强使容器容积缩小为原来的一半的瞬间,A的浓度是0.40mol/L。但再次达到平衡时,测得A的浓度为0.35mol/L,这说明增大压强,平衡向正反应方向移动,即正方应是体积减小的,因此选项ABC都是正确的,选项D不正确,C的体积分数增大,答案选D。
点评:该题是中等难度的试题,也是高考中的常见题型。试题设计新颖,难易适中。在注重对学生基础知识巩固和训练的同时,侧重对学生能力的培养和解题方法的指导与训练。该题的关键是明确瞬间浓度的变化与通过平衡移动引起的变化的区别,有利于培养学生的逻辑推理能力和抽象思维能力。

练习册系列答案
相关题目
 2HI(g) 达到平衡状态时的标志是
2HI(g) 达到平衡状态时的标志是 CO2(g)+H2(g);△H<0 试回答下列问题:
CO2(g)+H2(g);△H<0 试回答下列问题: pC(g) ?H=" Q" kJ·mol-1,在密闭容器中进行,右图表示在不同时间t、温度T和压强P与生成物C的百分含量的关系曲线,下列判断正确的是
pC(g) ?H=" Q" kJ·mol-1,在密闭容器中进行,右图表示在不同时间t、温度T和压强P与生成物C的百分含量的关系曲线,下列判断正确的是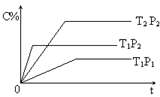
 2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表: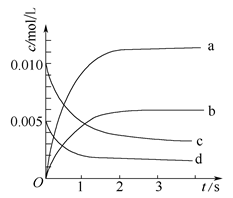
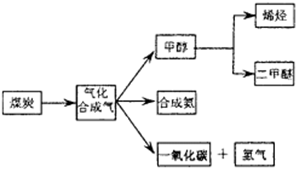
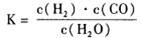
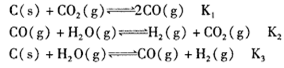
 , 该反应平衡常数随温度的变化如下:
, 该反应平衡常数随温度的变化如下:
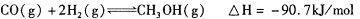
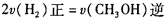
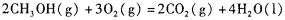 ,则负极的电极反应式为_______。
,则负极的电极反应式为_______。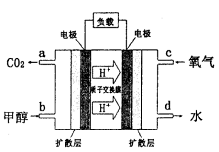
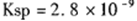 。 CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀。现将CaCl2溶液与
。 CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀。现将CaCl2溶液与 的Na2CO3溶液等体积混合,则生成沉淀时原CaCl2溶液的最小浓度为_______。
的Na2CO3溶液等体积混合,则生成沉淀时原CaCl2溶液的最小浓度为_______。