题目内容
黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其煅烧产物为SO2和Fe2O3。
(1)将0.050mol SO2(g)和0.030mol O2(g)放入容积为1L的密闭容器中,反应:
2SO2(g)+O2(g)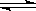 2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040mol·L-1。计算该条件下反应的平衡常数K和SO2的平衡转化率 、 。
2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040mol·L-1。计算该条件下反应的平衡常数K和SO2的平衡转化率 、 。

(2)已知上述反应是放热反应,当该反应处于平衡状态时,在体积不变的条件下,下列措施中有利于提高SO2平衡转化率的有 (填字母序号,多选倒扣分)。
A.升高温度 B.降低温度
C.增大压强 D.加入催化剂
E.移出氧气
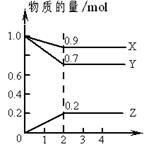
(3)某温度下,上述反应中SO2的平衡转化率(α)与体系总压强(p)的关系如右图所示。判断:平衡状态由A变到B时,平衡常数K(A)______K(B)(填“>”、“<”或“=”)。
(1)将0.050mol SO2(g)和0.030mol O2(g)放入容积为1L的密闭容器中,反应:
2SO2(g)+O2(g)
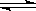 2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040mol·L-1。计算该条件下反应的平衡常数K和SO2的平衡转化率 、 。
2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040mol·L-1。计算该条件下反应的平衡常数K和SO2的平衡转化率 、 。
(2)已知上述反应是放热反应,当该反应处于平衡状态时,在体积不变的条件下,下列措施中有利于提高SO2平衡转化率的有 (填字母序号,多选倒扣分)。
A.升高温度 B.降低温度
C.增大压强 D.加入催化剂
E.移出氧气
(3)某温度下,上述反应中SO2的平衡转化率(α)与体系总压强(p)的关系如右图所示。判断:平衡状态由A变到B时,平衡常数K(A)______K(B)(填“>”、“<”或“=”)。
(1)1.6 103 80%
103 80%
(2)B C
(3)=
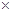 103 80%
103 80% (2)B C
(3)=
试题分析:
(2)该反应为放热反应,所以降低温度有利于提高SO2平衡转化率,又由于左边系数之和大于右边,所以增大压强也有利于提高SO2平衡转化率,加入催化剂不能提高SO2平衡转化率,移出氧气降低了SO2平衡转化率。故答案为B C。
(3)温度不变,平衡常数不变,所以K(A)=K(B)
点评:该题考查化学平衡的移动,是高考的考查重点,该题的信息量不大,也相对比较容易。

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案
相关题目
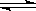 2NH3(g) ΔH<0。反应中NH3的物质的量浓度的变化情况如图所示。反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为
2NH3(g) ΔH<0。反应中NH3的物质的量浓度的变化情况如图所示。反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为
 pC(g) ?H=" Q" kJ·mol-1,在密闭容器中进行,右图表示在不同时间t、温度T和压强P与生成物C的百分含量的关系曲线,下列判断正确的是
pC(g) ?H=" Q" kJ·mol-1,在密闭容器中进行,右图表示在不同时间t、温度T和压强P与生成物C的百分含量的关系曲线,下列判断正确的是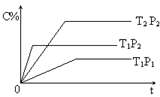
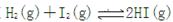 达到平衡状态时的标志是
达到平衡状态时的标志是 bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则下列说法不正确的是
bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则下列说法不正确的是